2.1. Psychobiologische Grundlagen
1 Institut für Psychologie, Allgemeine Psychologie II und Biologische Psychologie, Universität Osnabrück, Osnabrück, Germany
Vorbemerkung
Das vorliegende Kapitel beschreibt die psychobiologischen Grundlagen von Erleben und Verhalten mit dem Ziel, Bezüge zu medizinisch relevanten Inhalten herzustellen. Nach einer Übersicht über den Aufbau des Gehirns (s. Abschnitt 2.1.1.) werden die Lokalisation wichtiger psychischer Funktionen sowie insbesondere die Vernetztheit von Hirnstrukturen bei der Steuerung psychischer Funktionen dargestellt (s. Abschnitt 2.1.2.). Die Steuerung von Erleben und Verhalten wird u.a. durch die Aktion von Neurotransmittern moduliert. Diese Kenntnisse erlauben u.a. Vorhersagen für die Auswahl pharmakologischer Therapien zur Behandlung psychischer Störungen (s. Abschnitt 2.1.3.). Durch die bidirektionale Kommunikation zwischen endokrinem System (ES) und zentralem Nervensystem (ZNS) haben auch Hormone eine wichtige verhaltenssteuernde Funktion, was hier am Beispiel der Stresshormone, der Veränderungen während einer Stressreaktion und ihrer klinischen Relevanz erläutert wird (s. Abschnitt 2.1.4.). Das autonome (oder viszerale) Nervensystem hat neben seiner Bedeutung für die Konstanthaltung des inneren Milieus über den schnellen neuronalen Weg wichtige Funktionen bei psychologischen, insbesondere emotionalen Prozessen und stellt seinerseits auch eine wichtige Quelle afferenter Signale an das ZNS dar (s. Abschnitt 2.1.5.). Auch das Immunsystem (IS) liefert die physiologisch-anatomischen Voraussetzungen für eine bidirektionale Kommunikation zwischen IS und ZNS, aber auch zwischen IS und ES und es hat wichtige Schnittstellen zu medizinisch-relevanten Erlebens- und Verhaltensfunktionen (s. Abschnitt 2.1.6.). Dies wird an drei Beispielen dargestellt: anhand der Rolle proinflammatorischer Zytokine für das sog. „sickness behavior“, der Modulation von Immunparametern durch akuten und chronischen Stress und durch den Nachweis der klassischen Konditionierung von Immunparametern. Insgesamt adressiert das Kapitel also die vielfältigen Funktionen des Nervensystems.
Eine wesentliche Aufgabe des Nervensystems ist es, Verhalten und Erleben hervorzurufen und zu kontrollieren und - umgekehrt - wirken Erleben und Verhalten auf das Nervensystem und tragen damit wesentlich dazu bei, dass sich das Nervensystem durch diese Erfahrungen verändert. Diese Eigenschaft des Nervensystems wird als Neuroplastizität bezeichnet. Daraus ergibt sich die Bedeutung der Biopsychologie bzw. einer psychobiologischen Perspektive: Ziel ist es, die (neuro)biologischen Korrelate und - je nach Untersuchungsdesign - die Ursachen von psychologischen Prozessen (wie Wahrnehmung, Lernen, Emotion, Motivation, Gedächtnis, soziales Verhalten) zu ermitteln. Umgekehrt werden die Wirkungen von psychologischen Variablen auf (neuro)biologische Prozesse untersucht. Dabei werden nachfolgend Aussagen über gesunde Individuen getroffen und zugleich Prozesse beschrieben, die an Prozessen der Entstehung und Therapie von Erkrankungen beteiligt sind. Psychologische und biologische Funktionen interagieren jeweils bidirektional auch durch das Zusammenspiel zwischen Hormonsystem und Verhalten (s. Abschnitt 2.1.4.) und zwischen Immunsystem und Verhalten (s. Abschnitt 2.1.6.).
Das Nervensystem (NS) besteht aus zwei Hauptanteilen: dem zentralen Nervensystem (ZNS) und dem peripheren Nervensystem (PNS). Das ZNS umfasst Gehirn und Rückenmark, das PNS ist aufgeteilt in das somatische Nervensystem, die Hirnnerven (als eine Art Spinalnerven des Kopfbereichs) und das autonome (viszerale) Nervensystem. Das somatische Nervensystem – nicht explizit Gegenstand dieses Kapitels – dient der Interaktion mit der äußeren Umwelt. Hirnnerven versorgen den Kopf- und Halsbereich sensorisch und motorisch und haben über den Nervus vagus (Hirnnerv X.) auch Aufgaben bei der sensorischen und motorischen Versorgung des oberen Bauchraums. Das autonome (viszerale) Nervensystem erhält Afferenzen von den inneren Organen (Eingeweiden = Viscera) und sendet wiederum Efferenzen an diese. Wir werden uns in diesem Kapitel mit dem Gehirn (s. Abschnitt 2.1.1.) und mit dem autonomen Nervensystem (s. Abschnitt 2.1.5.) beschäftigen.
2.1.1. Aufbau des Gehirns
Die zellulären Bestandteile des ZNS sind Neuronen (Nervenzellen) und Gliazellen (Stützzellen).
|
Merkmal |
Ausprägung |
|
Gewicht (durchschnittlich) |
|
|
Anzahl Neuronen |
|
|
• im Gehirn gesamt |
|
|
• davon in der Großhirnrinde (Cortex) |
|
|
• davon im Kleinhirn (Cerebellum) • davon Nozizeptoren |
0 [2] |
|
Gesamtlänge aller Axone |
~160 000 km (~4-facher Erdumfang) [2] |
|
Oberfläche aller Neuronen Anzahl der Rechenoperationen pro Sekunde
|
25 000 m2 (4 Fußballfelder) [3] 1016 [2] |
|
Dicke des Cortex |
2–5 mm |
Das Gehirn ist eines der faszinierendsten Organe des Menschen. Zur Abschätzung seiner Bedeutung sind einige Merkmale in Tabelle 1 zusammengefasst.
Anmerkung: Beachte: In englischsprachigen Lehrbüchern erfolgt die Angabe als billion. Dabei entspricht 1 billion 1 Milliarde in deutschsprachigen Lehrbüchern.
Neuronen dienen der Informationsaufnahme, -integration und -weitergabe. Diese Aufgaben werden durch die Hauptregionen des Neurons, nämlich das Soma (Zellkörper) als Integrationszone, die Dendriten als Empfangszone, das Axon als Weiterleitungszone sowie die synaptischen Endigungen als Ort der Transmitterfreisetzung übernommen. Diese Bestandteile sind in Lehrbüchern der Neuroanatomie und Physiologie gut beschrieben. Aus psychobiologischer Perspektive betrachten wir hier nur die Dendriten und die dort erfahrungsabhängig entstehenden Veränderungen. Dendriten sind die um das Soma verteilten zahlreichen Verzweigungen, die die Empfangsstellen eingehender Signale darstellen. Ihre Fläche macht etwa 90% des Neurons aus. Vor allem in der Großhirnrinde (Cortex) und im Kleinhirn (Cerebellum) befinden sich auf den Dendriten viele sog. Dornen (engl. spines) [3]. An diesen Stellen befinden sich typischerweise auch Synapsen: Die synaptischen Spines sind wichtiger Austragungsort für Neuroplastizität und verändern sich erfahrungsbedingt: so durch wiederholte hochfrequente Nutzung derselben synaptischen Übergänge im Rahmen der sog. Langzeitpotenzierung (engl. long-term potentiation, LTP). LTP entsteht bei hochfrequenter Stimulation (>10–100 Hz) an einem präsynaptischen Neuron und bewirkt einen stabilen und langandauernden Anstieg der Aktivität und Effektivität der zugehörigen Synapse – auch bei nachfolgender nicht-tetanischer Stimulation der Präsynapse: Es kommt nun zu stärkeren exzitatorischen postsynaptischen Potentialen (EPSPs) an dieser Synapse. LTP wurde an Synapsen im Hippocampus und in der Amygdala (= Strukturen des Endhirns im limbischen System, vgl. Tabelle 2 und Abschnitt 2.1.2.5.) nachgewiesen. Auch Einwirkungen von Stress- und Sexualhormonen gehen mit Veränderungen an den synaptischen Spines einher. Es liegen tierexperimentell sehr differenzierte Befunde vor, wonach je nach Dauer des Stressors (chronisch vs. akut) und Hirnregion unterschiedliche Effekte eintreten. Chronischer Stress vermindert beispielsweise die Spines in dem für das Gedächtnis bedeutsamen Hippocampus und erhöht sie in der für Emotionen relevanten Amygdala.
Gliazellen sind eingeteilt in Makroglia und die der Immunabwehr dienende Mikroglia. Zu den Makrogliazellen gehören Astrozyten (als Teil der Bluthirnschranke [BHS] und Ort der Aufnahme überschüssiger Transmitter), Oligodendrozyten (im ZNS) und Schwannzellen (im PNS) zur Bildung der Myelinscheiden sowie Satelliten- und Ependymzellen. Unter Verwendung angemessener Methoden zur Bestimmung der Zellzahlen wurde ermittelt, dass die Gesamtzahl der Gliazellen im Gehirn derjenigen von Neuronen entspricht [4] und nicht – wie noch vielfach beschrieben – um den Faktor 10 höher ist.
Makroskopischer Aufbau: Das Gehirn ist makroskopisch – schon in der embryonalen Phase – in drei Hauptregionen aufgeteilt: das Proencephalon (Vorderhirn), das Mesencephalon (Mittelhirn) und das Rhombencephalon (Rautenhirn).
|
3 Hauptabschnitte |
Unterabschnitte |
Hauptstrukturen |
|
Proencephalon |
Telencephalon |
• Cerebraler Cortex (Endhirnrinde) mit Frontal-, Temporal-, Parietal- und Okzipitallappen • Limbisches Systema (davon im Telencephalon: Amygdala, Hippocampus, Septum, Gyrus cinguli, Inselrindeb,entorhinaler Cortexb ) • Basalkernec (Globus pallidus, Putamen, Nucleus caudatus)d |
|
|
Diencephalon |
• Thalamus • Epithalamus (Epiphyse und Epiphysenstiele) • Hypothalamus • Hypophyse • Subthalamus |
|
Mesencephalon |
Mesencephalon |
• Tectum (Dach) • Tegmentum (Haube) |
|
Rhombencephalon |
Metencephalon |
• Cerebellum (Kleinhirn) |
|
|
• Pons (Brücke) |
|
|
|
Mylencephalon |
• Medulla oblongata (verlängertes Mark) |
Anmerkungen: a: nur telencephale Anteile genannt; b: Inselrinde und entorhinaler Cortex nur in einigen Lehrbüchern dem limbischen System zugeordnet; c: es wird hier durchgängig der Begriff „Basalkerne“ benutzt – statt des üblichen Begriffs Basalganglien, da der Begriff Ganglien für Anhäufungen von Nervenzellen außerhalb des ZNS verwendet wird; d: Putamen und Nucleus caudatus werden als dorsales Striatum zusammengefasst, als weitere Struktur: Nucleus subthalamicus (im Diencephalon).
Im zweiten embryonalen Entwicklungsmonat sind bereits die Grobunterteilungen in fünf Abschnitte sichtbar (Tabelle 2): in das Telencephalon (Endhirn), das Diencephalon (Zwischenhirn), das Mesencephalon (Mittelhirn), das Rhombencephalon bestehend aus dem Metencephalon mit Brücke (Pons) und Kleinhirn (Cerebellum) sowie dem verlängerten Mark (Medulla oblongata), welches ohne Unterbrechung in das Rückenmark (Medulla spinalis) übergeht. Tabelle 2 benennt auch die Hauptstrukturen, die diesen Hirnabschnitten zugerechnet werden.
2.1.2. Lokalisation psychischer Funktionen
Die Zuordnung psychischer Funktionen zu Hirnstrukturen kann hier nur überblicksartig erfolgen. Zudem ist zu beachten, dass Betrachtungen zur Lokalisation psychischer Funktionen immer durch die Einbeziehung funktioneller Netzwerke ergänzt werden müssen, da die neurobiologische Vermittlung psychischer Funktionen in der Regel über mehrere Strukturen verteilt ist (hier dargestellt: Furchtnetzwerk und telencephales Schmerznetzwerk). Zudem tragen (die in den Hirnstrukturen arbeitenden) Transmitter (s. Abschnitt 2.1.3.) wesentlich zu den Wirkprofilen bei.
2.1.2.1. Myelencephalon
Das verlängerte Mark (Medulla oblongata) erfüllt Aufgaben bei der Regulation vitaler Funktionen, nämlich von Herz-Kreislauf-Funktionen, von Nies-, Schluck- und Hustenreflexen, von Erbrechen und motorischen Funktionen [5]. Auch enthält es die Kerngebiete der epikritischen Sensibilität und ist damit relevant für die feine Tastwahrnehmung und Wahrnehmung der Stellung der Gelenke (Propriozeption). Als netzartige Struktur durchzieht die Formatio reticularis die Medulla oblongata und die Brücke bis zum Mittelhirn. Sie enthält weit verzweigte Neuronennetzwerke, die Kerngebiete einzelner Hirnnerven sowie die Hauptbildungsstätten der Transmitter Noradrenalin (im Locus coeruleus) und Serotonin (in den Raphé-Kernen). Aus der aktivierungsmodulierenden Funktion der aufsteigenden Bahnen und aus dem Wirkprofil der Transmitter (s. auch Abschnitt 2.1.3.) ergibt sich die Bedeutung der Formatio reticularis für die Regulation der allgemeinen Aktivierung des Cortex bzw. für das Arousal, für die Regulation von Schlaf und Schlaf-Wach-Zyklus, für Schmerzmodulation, für die Aufrechterhaltung des psychischen und physischen Gleichgewichts (Homöostase) und des Befindens.
2.1.2.2. Metencephalon
Die Brücke (Pons) ist eine Durchgangsstation sowohl für auf- bzw. absteigende Fasern als auch für die Übertragung der Informationen vom und zum Kleinhirn [5].
Das Kleinhirn (Cerebellum) leistet wesentliche Aufgaben bei der zeitlichen und prozeduralen Koordination, Taktung und Feinabstimmung von Bewegungsabläufen und ihrer Automatisierung (wie z.B. Klavierspielen oder Radfahren), bei der Wahrnehmung von Rhythmus und bei der Steuerung des Gleichgewichts. Es ist dabei – neben Neocortex und Basalkernen – für das Erlernen und die Gedächtnisspeicherung der automatisierten Bewegungsabläufe (sog. prozedurales Gedächtnis) zuständig. Ein weiterer Indikator seiner kognitiven Leistungen ist die Beteiligung am Lernprozess der klassisch konditionierten (s. Kapitel 2.2.3.) Lidschlussreaktion. Konditionierte Lidschlussreaktion bedeutet, dass ein zunächst mit einem Luftstoß gekoppelter neutraler Reiz (z.B. ein Ton) schließlich als konditionierter Stimulus (CS) schon ohne Luftstoß den Lidschluss auslöst. Klinik: Merkmale von Kleinhirnschädigungen sind ipsilaterale Bewegungsauffälligkeiten. Bewegungen sind unkoordiniert, die Patienten sind nicht fähig, schnelle Bewegungen im Wechsel auszuführen, ihr Gang ist taumelnd und unsicher. Es zeigen sich folgende Veränderungen: ein – bei geplanten Bewegungen auftretender – Intentionstremor, eine generelle Schlaffheit der Muskulatur, Störungen des Gleichgewichts und Defizite in den genannten kognitiven Leistungen (wie der konditionierten Lidschlussreaktion).
2.1.2.3. Mesencephalon (Mittelhirn)
Im Dach des Mittelhirns (Tectum) sind die oberen Vierhügel (Colliculi superiores) lokalisiert, die für die Verarbeitung und Weiterleitung visueller Reize, die Steuerung der Augenbewegungen und die Integration visueller und akustischer Information bedeutsam sind; die unteren Vierhügel (Colliculi inferiores) leisten diese Aufgaben im akustischen System. In der Haube des Mittelhirns (Tegmentum) befinden sich das zentrale Höhlengrau (periaquäduktales Grau, PAG), die Substantia nigra, der Nucleus ruber und das ventrale tegmentale Areal (VTA). Das PAG ist für das Erstarren (engl. freezing) zuständig, das in furchtauslösenden Situationen auftritt und ist damit Bestandteil des Furchtnetzwerks (Abbildung 3). Es ist auch der Ort der Freisetzung körpereigener Opiate, die in die absteigende Schmerzhemmung einbezogen sind. Die Substantia nigra ist der Hauptursprungsort dopaminerger Neuronen. Eine Degeneration dieser Neurone liegt u.a. der Parkinson-Erkrankung zugrunde: Aufgrund des Dopaminmangels können die Basalkerne im Endhirn das Zusammenspiel motorikfördernder (exzitatorischer) und motorikhemmender (inhibitorischer) Aktionen nicht mehr angemessen koordinieren. Auch das VTA enthält dopaminerge Neuronen und ist Ausgangsort dopaminerger Projektionen in Teile des limbischen Systems (den Nucleus accumbens) und Belohnungszentren im präfrontalen Cortex (s. Dopamin, mesolimbisches und mesocorticales System, Abschnitt 2.1.3.) (vgl. Kapitel 2.2.3.).
2.1.2.4. Diencephalon (Zwischenhirn)
Der Thalamus, der etwa 80% der Fläche des Zwischenhirns ausmacht, gilt als „Tor zum Bewusstsein“, da die Afferenzen aus den verschiedenen sensorischen Systemen in den Thalamuskernen ihre letzte Umschaltstelle auf dem Weg zu den primären sensorischen Rindengebieten haben. Ausnahme sind die Signale der olfaktorischen Sinneszellen: Sie erreichen zunächst ihren primären olfaktorischen Cortex (den pyriformen und entorhinalen Cortex) im Temporallappen, bevor u.a. Projektionen in den Thalamus erfolgen. Die thalamische Umschaltung steht auch unter corticaler Kontrolle, indem besonders diejenigen Inhalte den „Flaschenhals“ des Thalamus passieren, die gerade im Zentrum der Aufmerksamkeit sind. Teile des Thalamus sind auch in die Steuerung motorischer Funktionen, in Schmerzverarbeitung und Gedächtnis eingebunden. Hypothalamus: Der Hypothalamus ist die Steuerzentrale für Hormonausschüttung und wirkt durch Freisetzung von Releasing-Hormonen (freisetzungsfördernd) und Inhibiting-Hormonen (freisetzungshemmend) auf die nachgeschaltete Hypophyse (genauer in Abschnitt 2.1.4.). Er koordiniert zudem weitere Regelkreise, die das physiologische Gleichgewicht (die Homöostase) sichern, nämlich Temperaturregulation, Blutzuckerregulation und Stoffwechsel, Hunger und Essverhalten sowie Durst. Über den kleinen hypophysären Pfortaderkreislauf ist der Hypothalamus mit dem Hypophysenvorderlappen (HVL, Adenohypophyse) und über Axone, also nerval, mit dem Hypophysenhinterlappen (HHL, Neurohypophyse) verbunden (s. Abschnitt 2.1.4.). In der Epiphyse wird das Hormon Melatonin freigesetzt, das in die Schlaf-Wach-Regulation eingebunden ist.
2.1.2.5. Telencephalon (Endhirn)
Das Endhirn macht den größten Anteil des menschlichen Gehirns aus. Die Hirnrinde (Cortex) des Menschen besteht aus vielen Windungen (Gyri) und Vertiefungen (Sulci), was der Oberflächenvergrößerung dient. 90% der Cortexoberfläche des Menschen sind dem Neocortex zugerechnet, der aus sechs Zellschichten besteht. Den restlichen Anteil des Cortex nimmt der 3- bis 5-schichtige Allocortex mit den stammesgeschichtlich alten Rindengebieten (z.B. dem Riechhirn) ein. Einen Übergang zwischen Allo- und Neocortex stellt der Gyrus cinguli (cingulärer Cortex) dar – die am tiefsten liegende Windung der Hirnrinde, die von frontalen bis zu okzipitalen Regionen zieht. Die in das Telencephalon eingelagerten subcorticalen Kerngebiete sind das limbische System und die Basalkerne.
Neocortex
Der Neocortex beherbergt primäre und sekundäre sensorische und motorische Areale sowie multimodale Assoziationsareale in den vier Hirnlappen: dem Frontallappen (Vorderlappen), dem Temporallappen (Schläfenlappen), dem Parietallappen (Scheitellappen) und dem Okzipitallappen (Hinterhauptslappen). Anhand der unterschiedlichen zytoarchitektonischen Merkmale wurde der Neocortex durch den Anatomen Korbinian Brodmann (1868–1918) in 52 Areale aufgeteilt (vgl. Abbildung 1 zu einer großen Zahl dieser Areale).
Organisation der Sinnessysteme durch primäre, sekundäre sensorische Areale und multimodale Assoziationsareale
Primäre sensorische Rindengebiete stellen die erste Anlaufstation der verschiedenen Sinnesbahnen im Cortex dar: Information wird hier relativ interpretationsfrei repräsentiert (im primären visuellen Cortex, Area 17, etwa Form und Farbe von Objekten). Sekundäre sensorische Rindengebiete (auch als sensorische Assoziationsareale bezeichnet) leisten eine komplexere Informationsverarbeitung im Sinne der Analyse: Woher kommt ein Reiz? Was ist seine Bedeutung? Schließlich werden die multimodalen Assoziationsareale erreicht. Die prinzipielle Organisation des Informationsflusses ist für die verschiedenen sensorischen Systeme gleich (vgl. Kapitel 2.2.1.).
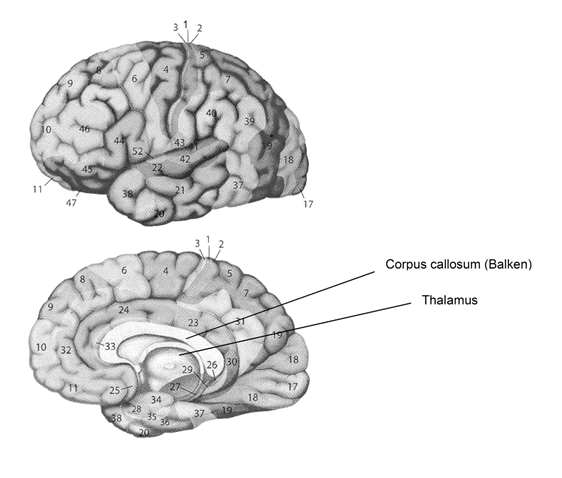
Zu Abbildung 1: Wichtige Areale (A) in Frontal-, Parietal-, Temporal- und Okzipitallappen und Funktion dieser Areale: Frontallappen: A4: primärer motorischer Cortex; A6 und Teile von A8: sekundärer motorischer Cortex [prämotorischer, (prä)supplementär-motorischer Cortex];
A8: posteriorster Teil des präfrontalen Cortex [3] und frontales Augenfeld; A9, A46: dorsolateraler präfrontaler Cortex [3]; A10: frontopolarer Cortex [3]; A11–A14; A25: ventraler präfrontaler Cortex [3]; A24: Gyrus cinguli; A24, A32: medialer präfrontaler Cortex [3]; A44, A45: motorisches Sprachzentrum (Broca-Areal); A44, A45, A47: ventrolateraler präfrontaler Cortex [3]. Parietallappen: A1–A3: primärer somatosensorischer Cortex (SI); A5, A7: sekundärer somatosensorischer Cortex (SII); A23, A30: Gyrus cinguli; A39: Gyrus angularis. Temporallappen:
A28, A34: entorhinaler Cortex; A29, A30: Gyrus cinguli; A37: fusiformer Gyrus; A41: primäre Hörrinde; A22, A42: sekundäre Hörrinde, sensorisches Sprachzentrum (Wernicke Areal). Okzipitallappen: A17: primärer visueller Cortex; A18: sekundärer visueller Cortex; A19: visueller Assoziationscortex.
In allen primären sensorischen Rindengebieten ist die Repräsentation (a) „topisch“ im Sinne einer Landkarte organisiert, wobei diese Landkarte (b) gleichzeitig verzerrt ist wie Güntürkün ausführt [3]:
(a) Landkarte: benachbarte Repräsentationsorte auf dem Cortex korrespondieren mit benachbarten Orten der Reizung in den rezeptiven Feldern der Peripherie. So ist z.B. die Repräsentation im primären somatosensorischen Cortex (Gyrus postcentralis, Areale 1–3) des Parietallappens somatotop organisiert, indem Punkte, die nebeneinander auf der Haut liegen, auch auf dem Cortex benachbart repräsentiert sind. Der primäre visuelle Cortex im Okzipitallappen (Areal 17) zeigt eine retinotope Repräsentation; in der primären Hörrinde im Temporallappen (Areal 41) erfolgt eine tonotope (nach Frequenz kodierte) Repräsentation. Der primäre gustatorische Cortex - in basalen Regionen des Frontallappens und der Inselrinde - liefert eine (wenn auch idiosynkratische, d.h. für jedes Individuum einzigartige) Repräsentation nach Geschmacksqualität.
(b) Die Landkarte im Cortex ist zugleich verzerrt: Gebiete mit hoher Rezeptordichte in der Peripherie werden im Cortex (überproportional) großflächig abgebildet. Diese Überrepräsentation wichtiger Regionen unserer Wahrnehmung entsteht dadurch, dass die Rezeptoren im Cortex äquidistant abgebildet sind, wodurch Regionen hoher Rezeptordichte aus peripheren rezeptiven Feldern im Cortex mehr Raum einnehmen [3]. Klinik: Läsionen in den primären sensorischen Gebieten führen zu einer Einschränkung der bewussten Wahrnehmung dieses Sinnes.
Nachgeordnete sekundäre Rindenfelder (sensorisch assoziative Areale) verknüpfen die Erfassung einfacher Reizmerkmale mit der Erkennung von Objekten. So wird etwa im sekundären somatosensorischen Cortex (Areale 5, 7) die Tastinformation mit der Erkennung eines Objekts (als Tasse, Ball oder Orange) verknüpft. Klinik: Eine Schädigung dieser Areale führt zur taktilen Agnosie: Gegenstände können durch den Tastsinn nicht mehr erkannt werden.
In multimodalen Assoziationsarealen werden die Informationen aus verschiedenen Sinnesmodalitäten integriert und mit motivationalen und emotionalen Inhalten assoziiert [3]. Die größten Assoziationsbereiche liegen im temporalen, parietalen und präfrontalen Cortex. Assoziationsareale im temporalen Cortex leisten die Verknüfung von visuellen mit auditorischen Signalen; dies ermöglicht u.a., dass die akustische Wahrnehmung eines Wortes auch eine visuelle Erinnerung an einen Gegenstand auslöst. Assoziationsgebiete im parietalen Cortex sind an der Planung gezielter Greifbewegungen im dreidimensionalen Raum beteiligt. Sie sind auch Ort der Verarbeitung von Rechenleistungen (z.B. Additionsleistungen): dies ist naheliegend, da arithmetische Leistungen häufig eine räumliche Verarbeitung nutzen (z.B. Ordnung numerischer Werte in einem räumlichen Zahlenstrahl) [3]. Die komplexesten assoziativen Leistungen erbringt der präfrontale Cortex (= alle frontalen Brodman-Areale außer Areal 4 [primärer motorischer Cortex] und Areal 6 [sekundärer motorischer Cortex]) [3]. Zu den Aufgaben des präfrontalen Cortex gehören die Handlungskontrolle (eher anterior-posteriore Achse) und emotionsbezogene Funktionen (ventrale Anteile der dorso-ventralen Achse). Handlungskontrolle umfasst dabei Aufgaben von der einfachen regelbasierten Handlungsauswahl (posteriorster Teil des präfrontalen Cortex, Areal 8), über die Fehlerüberwachung und -kontrolle und Realitätsprüfung (dorsomedialer präfrontaler Cortex) bis zur Überwachung gleichzeitig ablaufender kognitiver Suchprozesse (dorsolateraler präfrontaler Cortex, Areale 9, 46). Der frontopolare Pol (Areal 10) übernimmt die übergeordnete Kontrolle der Kontrollprozesse bzw. der Kontrolleure [3]. Ventrale Anteile: Der ventrolaterale präfrontale Cortex (Areale 44, 45, 47) ist einbezogen in den Abruf von Gedächtnisinhalten, deren Auffinden schwierig ist und bei denen sich viele alternative Gedächtnisinhalte aufdrängen [3]. Der ventrale präfrontale Cortex (Areale 11–14, 25) ist beteiligt bei Entscheidungsprozessen, bei denen emotionale Erfahrungen, der subjektive Wert bzw. Nutzen und der mögliche negative Ausgang von neuen Entscheidungen berücksichtigt wird [3]. Der mediale präfrontale Cortex (Areale 24, 32) spielt eine wichtige Rolle bei der Bewertung eigener Leistungen und sozialer Kognition. Er enthält u.a. den anterioren Gyrus cinguli, der an Empathie (insbesondere für unangenehme Erfahrungen wie Schmerz) beteiligt ist [3]. Er ist auch Ort für Furchtgedächnis und Furchtabruf. Der ventromediale präfrontale Cortex ist wichtig für Emotionsregulation – etwa bei der Furchtextinktion (vgl. Furchtnetzwerk) (vgl. Kapitel 2.2.7.).
Organisation von Bewegung durch motorische Rindengebiete
Der Informationsweg im motorischen Cortex besteht darin, dass sekundäre motorische Rindengebiete zum primären motorischen Cortex projizieren. Der primäre motorische Cortex – auch somatotop organisiert – startet dann abschließend die endgültige geplante motorische Aktion.
Folgende Informationen werden dem primären motorischen Cortex über die sekundären motorischen Rindengebiete (Areal 6 und Teile von Areal 8) zugeleitet:
- Der prämotorische Cortex ist bedeutsam für das Erlernen und Ausüben komplexer Bewegungen, die unter der Kontrolle willkürlicher sensorischer Reize stehen, etwa wenn wir eine Bewegung nach verbaler Aufforderung ausführen (so z.B. Tänzer, die eine bestimmte Drehung nach verbaler Ansage des Choreographen ausführen). Er enthält außerdem – ebenso wie der untere Parietallappen – motorische Spiegelneuronen. Motorische Spiegelneuronen (erstmals 1996 in der Arbeitsgruppe um Rizzolatti bei Primaten beschrieben), sind sowohl aktiv, wenn wir selber Greifbewegungen ausüben oder Gegenstände manipulieren, als auch dann, wenn wir solche Bewegungen bei anderen beobachten. Sie werden besonders stark bei der Beobachtung solcher Bewegungen aktiviert, die wir selber gut beherrschen. Auch können sie ggf. durch akustische Informationen aktiviert werden, etwa wenn Pianisten die Klänge eines Musikstücks hören, das sie gut motorisch ausführen (spielen) können [7].
- Das supplementär-motorische Areal dient der Vorbereitung von Bewegungssequenzen und erhält seinerseits Afferenzen aus dem Parietallappen [7].
- Der prä-supplementär-motorische Cortex ist in die Vorbereitung einer absichtsvollen Bewegung einbezogen [7].
Kerngebiete des Endhirns
Limbisches System
Unter dem Begriff limbisches System (1949 durch McLean erstmals verwendet) werden (durchaus heterogene) Hirnstrukturen zusammengefasst, die sich in der Grenzregion (Limbus, „Grenze“) des Cortex zum Hirnstamm befinden. Wesentliche Funktion des limbischen Systems ist die Erzeugung und Organisation unserer Emotionen (s. Kapitel 2.2.7.). Aber auch Gedächtnisfunktionen sind hier lokalisiert.
Strukturen, die dem limbischen System zumeist zugeordnet werden (s. Abbildung 2A), sind die Amygdala, das Septum, der Gyrus cinguli, die Hippocampusformation (mit Ammonshorn [Cornu ammonis], Gyrus dentatus, Subiculum). Hinzu kommen die anterioren Kerne des Hypothalamus, die Mamillarkörper und der Fornix (= Verbindung zwischen Mammilarkörper und Hippocampus). In einzelnen Lehrbüchern werden zwei weitere telencephale Strukturen dem limbischen System zugerechnet, nämlich die Inselrinde und der entorhinale Cortex.
Amygdala
Die Amygdala (im medialen Temporallappen lokalisiert) ermöglicht u.a., bedrohliche Reize in frühen Verarbeitungsschritten (bevor sie den Neocortex erreicht haben) zu erkennen und darauf sehr schnell zu reagieren. Sie ist die wichtigste Struktur („zentrales Nadelöhr“) für die Zusammenführung von sensorischen Eingängen (Input) und ausgehenden Reaktionen (Output) (s. Abbildung 3). Die wichtigsten Kerne sind der laterale, der basale, der mediale und der zentrale Kern. Der laterale (LA) Kern dient als Eingangsstation und erhält afferenten Zustrom thalamischer Regionen des auditorischen, visuellen, olfaktorischen, somatosensorischen und nozizeptiven Systems und Signale aus dem olfaktorischen Cortex. Der LA-Kern projiziert die eingehenden Informationen zudem zu den primären sensorischen Cortexgebieten, um die genaue Analyse der sensorischen Informationen zu ermöglichen. In bedrohlichen Situationen wird dieser lange, genauere Weg über die sensorischen Cortexareale umgangen und es werden direkt Reaktionen über die Outputregion der Amygdala, den zentralen Kern (CE), eingeleitet (engl. low road oder quick-and-dirty way). Der LA-Kern leitet die Signale auch zur basalen Amygdala (BA) weiter. Der CE ist die Outputregion der Amygdala – und initiiert Verteidigungsreaktionen (defensive Reaktionen): Über das periaquäduktale Grau (PAG) des Mittelhirns werden Erstarren (engl. freezing) und eine Abnahme der Schmerzwahrnehmung (durch Bildung körpereigener Opioide) veranlasst. Durch Verbindung mit Kerngebieten im Hirnstamm wird die Bildung von Noradrenalin (im Locus coeruleus) und Serotonin (in den Raphé-Kernen) angeregt. Der CE aktiviert auch hypothalamische Areale, die eine erhöhte Aktivität des sympathischen Nervensystems und die Aktivierung der Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HHNA) herbeiführen, um eine Anpassung an die emotionale Bedrohung zu ermöglichen; hier ergeben sich auch Überschneidungen zur Auslösung von Stressreaktionen (vgl. Abschnitt 2.1.4.). Der mediale Kern (ME) erhält vor allem Input vom olfaktorischen System und ist mit dem medialen Hypothalamus wechselseitig verbunden. Er ist wesentlich in die Kontrolle von Aggression und Sexualverhalten eingebunden [3] (vgl. Kapitel 2.2.7.).
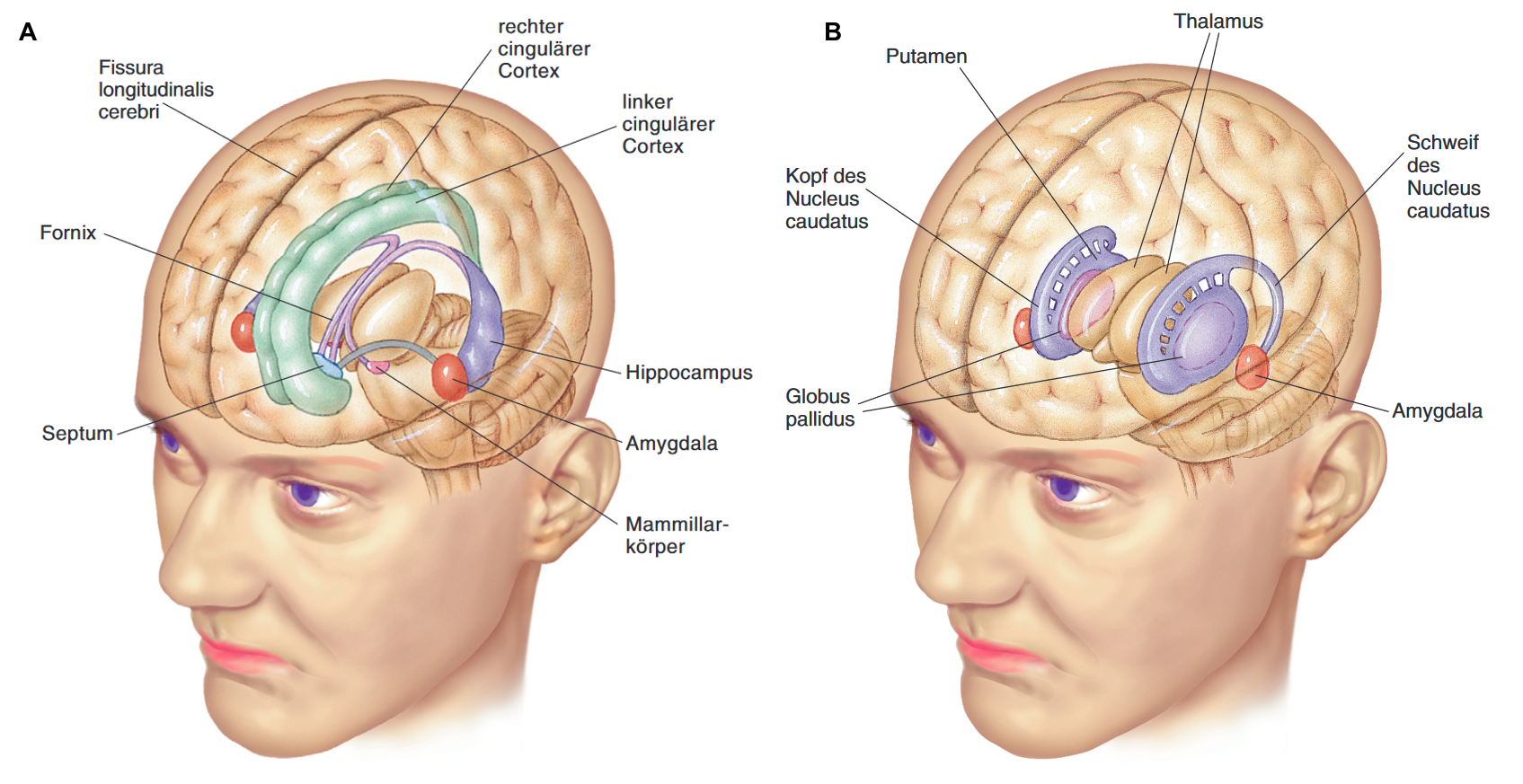
2A: Limbisches System: Telencephale Anteile (Amygdala, Hippocampus, cingulärer Cortex, Septum) und diencephale Anteile (Mamillarkörper), Fornix als Verknüpfung von Mamillarkörpern und Hippocampus. (Quelle: Pinel, John P. J.; Barnes, Steven J.; Pauli, Paul: Biopsychologie, 10., aktualisierte und erweiterte Auflage, Pearson Deutschland, Hallbergmoos 2019, S. 84, Abbildung 3.27 [8], mit Genehmigung des Verlags. Diese Abbildung/Tabelle ist von der CC-BY 4.0 Lizenzierung ausgenommen, eine Nachnutzung bedarf der Genehmigung des Verlages Pearson Deutschland). In einzelnen Lehrbüchern werden die (telencephale) Inselrinde und der entorhinale Cortex dem limbischen System zugerechnet.
2B: Die Basalkerne (Quelle: Pinel, John P. J.; Barnes, Steven J.; Pauli, Paul: Biopsychologie, 10., aktualisierte und erweiterte Auflage, Pearson Deutschland, Hallbergmoos 2019, S. 85, Abbildung 3.28, in der Legende der Originalabbildung 3 [8], mit Genehmigung des Verlags. Diese Abbildung/Tabelle ist von der CC-BY 4.0 Lizenzierung ausgenommen, eine Nachnutzung bedarf der Genehmigung des Verlages Pearson Deutschland). In [8] wird darauf verwiesen, dass sich bei diesem Blickwinkel der rechte Globus pallidus zu einem großen Teil hinter dem rechten Thalamus befindet und der linke Globus pallidus völlig hinter dem linken Putamen verborgen ist.
Hippocampus
Das Nervengewebe des Hippocampus ist ein leicht erregbares Gewebe. Die Hippocampusformation (mit Ammonshorn [Cornu ammonis, CA], Gyrus dentatus und Subiculum) spielt eine wichtige Rolle bei der Konsolidierung deklarativer Gedächtnisinhalte (s. Kapitel 2.2.4.) und auch beim Abruf dieser Inhalte.Deklarative Gedächtnisinhalte sind Gedächtnisinhalte, die sich sprachlich reproduzieren („deklarieren“) lassen, nämlich Faktenwissen (semantisches Gedächtnis) und episodisches (u.a. biographisches) Gedächtnis. Konsolidierung ist die Überführung der Gedächtnisinhalte vom Kurzzeit- bzw. Arbeitsgedächtnis in das Langzeitgedächtnis. Der Hippocampus ist dabei nicht der Speicherort des Langzeitgedächtnisses (dies geschieht im Neocortex), sondern der Ort der Konsolidierung der Gedächtnisinhalte und der Ort des Abrufs der Gedächtnisinhalte vor Abschluss der Konsolidierung [2]. Er hat zudem eine wichtige Funktion für räumliche Orientierung und räumliches Gedächtnis, indem er die Position im Raum mittels sog. Ortszellen (engl. place cells) kodiert.
Aufgrund der hohen Dichte von Glukokortikoidrezeptoren (GRs) und Mineralkortikoidrezeptoren (MRs) ist der Hippocampus auch sehr empfänglich für die Wirkung von Stresshormonen (vgl. Abschnitt 2.1.4.2., Kapitel 2.2.4. und Kapitel 2.2.7.).
Fallvignette
Die Bedeutung des Hippocampus wird in der Literatur eindrucksvoll dokumentiert an dem Patienten HM (Henry Gustav Molaison, 1926–2008), bei dem im Alter von 27 Jahren wegen einer schweren Epilepsie eine beidseitige Entfernung von weiten Teilen des medialen Temporallappens – und damit u.a. des linken und rechten Hippocampus – vorgenommen wurde. HM entwickelte eine massive anterograde Amnesie (vgl. Kapitel 2.2.4.) für deklarative, nach dem Trauma erworbene Inhalte. Das Gedächtnis für prozedurale Inhalte (Bewegungsabläufe) war nicht betroffen: so lernte HM das sog. Spiegelnachzeichnen (Nachzeichnen einer Figur, z.B. eines Sterns, in einer vorgegebenen Begrenzung nur anhand der Sicht auf ein Spiegelbild der zeichnenden Hand) und zeigte dabei Leistungsverbesserungen über den Verlauf der Trainingstage. Er konnte sich aber nicht erinnern (= biographisches deklaratives Gedächtnis), diese Aufgabe jemals durchgeführt zu haben. Intelligenz, Handlungsfähigkeit und kognitive Operationen (wie Sprechen, logische Schlussfolgerung) blieben erhalten. Der Fall HM demonstriert u.a., dass verschiedene Gedächtnisformen (deklaratives vs. non-deklaratives Gedächtnis) unabhängig voneinander gebildet werden und unterschiedliche Speicherorte haben.
Anteriorer Gyrus cinguli
Der anteriore Gyrus cinguli (engl. anterior cingulate cortex, ACC) ist einbezogen in die Erwartung von Belohnung, in Emotionen und die Verarbeitung der affektiven Komponenten von Schmerz und Empathie sowie auch Fehlerentdeckung. Der posteriore Gyrus cinguli (engl. posterior cingulate cortex, PCC) leistet Aufgaben bei räumlicher Orientierung und Gedächtnis.
Septum
Dem Septum kommt eine wichtige Funktion für Belohnung und Lustempfinden zu. Weitere Belohnungszentren sind im mesolimbischen System lokalisiert (vgl. Abschnitt 2.1.3.4., Dopamin, und Kapitel 2.2.6.).
Inselrinde
Die Inselrinde ist eine Schaltstelle für die Verknüpfung zwischen vegetativen Reaktionen und Emotionen; eine Aktivierung der Inselrinde entsteht beispielsweise bei Ekel, Interozeption und Schmerz (vgl. Kapitel 2.2.7. und Kapitel 2.8.3.).
Basalkerne
Die Basalkerne (Basalganglien) bestehen aus dem Nucleus caudatus, dem Putamen, dem Globus pallidus interna (GPi) und externa (GPe) und dem Nucleus subthalamicus im Diencephalon. Nucleus caudatus und Putamen werden als dorsales Striatum zusammengefasst (s. Abbildung 2B). Die Basalkerne sind untereinander verschaltet und ermöglichen so einen schleifenförmigen Informationsfluss (vom Cortex über die Basalkerne, den ventroanterioren [VA] und ventrolateralen [VL] Kern des Thalamus und zurück zum Cortex). Sie modulieren die motorischen Impulse des Cortex dabei durch motorikfördernde Verschaltungen (direkter Pfad) sowie durch motorikhemmende Verschaltungen (indirekter Pfad) und ermöglichen den plötzlichen Stopp einer (im Motorcortex) schon geplanten Bewegung (hyperdirekter Pfad) (vgl. [7]). Umgekehrt werden die Basalkerne über geplante Bewegung informiert und überwachen somatosensorische Information. Basalkerne sind auch Speicherort des prozeduralen Gedächtnisses (s. Kapitel 2.2.4.).
Klinik: Die Arbeit der Basalkerne ist dopaminabhängig. Demzufolge zeigen Patienten mit einer Parkinson-Erkrankung Bewegungsstörungen mit fehlender Abstimmung motorikfördernder und -hemmender Impulse. Symptome bestehen sowohl in gesteigerter Bewegung (Ruhetremor, Steifheit [Rigor]) als auch in Bewegungsverlangsamung und mangelnder (mimischer) Bewegung (Akinese). Die pharmakologische Therapie besteht u.a. in der Gabe des Dopamin-Vorläufers L-Dopa (da Dopamin die BHS nicht passieren kann). Erfolgreich ist auch die tiefe Hirnstimulation des Nucleus subthalamicus [7]. Eine erhöhte Aktivation der Basalkerne zeigt sich dagegen bei Patienten mit einer Zwangsstörung, die stereotypes motorisches Verhalten (Zwangshandlungen) ausüben.
Diejenigen dopaminergen Projektionen, die ihren Ursprung im VTA des Mittelhirns haben, erreichen den Nucleus accumbens, auch als ventrales Striatum bezeichnet. Diese Projektionen sind bedeutsam für Belohnungsprozesse (s. Abschnitt 2.1.3.4., Dopamin).
2.1.2.6. Funktionelle Netzwerke
Das Furchtnetzwerk und klassische Konditionierung von Furcht
Die wesentlichen neuronalen Strukturen der Furcht und Furchtregulation sind über ein Netzwerk verbunden, das in ungelernten bedrohlichen Situationen, aber auch bei gelernter, konditionierter Furcht beteiligt ist. Es umfasst Kerngebiete der Amygdala, den Hippocampus und Areale des medialen präfrontalen Cortex (s. Abbildung 3). Die Untersuchung des Furchtnetzwerks leistet wichtige Beiträge zur Aufklärung von Mechanismen, die an Entstehung, Aufrechterhaltung und Therapie von Angststörungen, stressor- und trauma-bezogenen Störungen (wie der Posttraumatischen Belastungsstörung, PTBS) beteiligt sind. Im Labor werden dazu Versuchsanordnungen zur klassischen Konditionierung von Furcht benutzt (vgl. [9]).
Klassische (Pawlowsche) Konditionierung ist ein assoziativer Lernprozess, der unter Beteiligung des ZNS erfolgt. In der Akquisition erwirbt der Organismus eine Verknüpfung (Assoziation) zwischen zwei Reizen, nämlich zwischen einem zunächst neutralen Reiz (z.B. Ton) und einem biologisch bedeutsamen unkonditionierten Stimulus (US) (z.B. Elektroschock), der zuverlässig ohne Lernerfahrung eine unkonditionierte Reaktion (UR) (z.B. Furcht) auslöst. Durch die Kopplung wird der neutrale Reiz zu einem konditionierten Stimulus (CS), der dann auch ohne US eine nun konditionierte Reaktion (CR) (z.B. konditionierte Furcht) auslöst. Die CR wird verlernt (gelöscht, extingiert), wenn der CS ohne den US verabreicht wird. Diese Extinktion gilt als ein eigener Lernprozess mit den Phasen Extinktionsakquisition, Konsolidierung und Abruf des Extinktionsgedächtnisses. Eine aktuelle Annahme ist, dass in der Extinktion eine neue (inhibitorische) Assoziation gelernt wird, nämlich dass auf den CS kein US folgt („CS – no US“) (vgl. [10]) (vgl. Kapitel 2.2.7.).
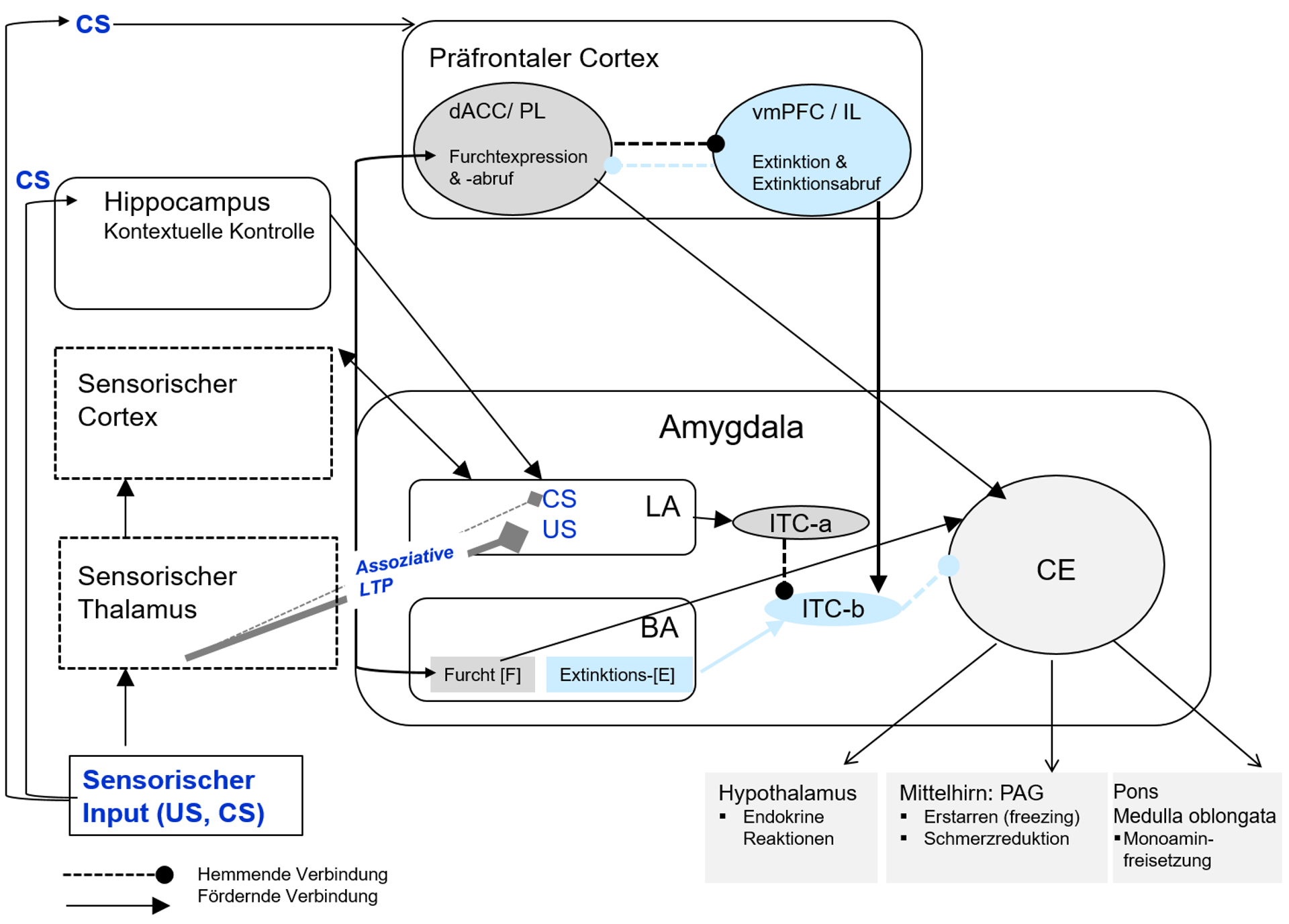
Im lateralen Kern (LA) der Amygdala konvergieren die sensorischen Informationen über den CS (z.B. einen Ton) und den aversiven US (z.B. Elektroschock) und werden synaptisch verschaltet; der LA ist damit der Ort der assoziativen LTP [7]. Der LA projiziert zum BA der Amygdala, wo sich zwei Arten von Neuronen befinden, Furchtneuronen und Extinktionsneuronen (vgl. [10]). Diese sind verschaltet mit den sog. interkalierten Zellen (ITCa und ITCb). Furchtneuronen unterhalten exzitatorische Projektionen zu Neuronen im CE, d. h. sie fördern die Auslösung der defensiven Furchtreaktionen (Furchtexpression) und ermöglichen den Furchtabruf. Extinktionsneurone sind dagegen dann aktiv, wenn Furcht extingiert wird und sind für den erfolgreichen Extinktionsabruf bedeutsam, u.a. indem sie die hemmenden Effekte der ITC-b auf den CE anregen. Dabei ist zu beachten, dass in der Extinktion eine neue Assoziation, nämlich die sog. CS-no-US-Assoziation, gelernt wird: sie beinhaltet, dass auf den CS nun kein US mehr folgt. Die ursprüngliche Assoziation bleibt dabei durchaus noch bestehen. Der Hippocampus, der auch mit der Amygdala verschaltet ist, ist wichtig für die Kontextspezifität der Furcht: So kann konditionierte Furcht in einer neuen Umgebung durchaus auftreten, nachdem sie schon erfolgreich in einer anderen Umgebung extingiert wurde. Dadurch lässt sich z.B. ein Rückfall (engl. relapse; siehe auch Kapitel 2.2.3. zur Spontanerholung) mit erneutem Auftreten von Angst in einem neuen Kontext (engl. renewal) nach einer schon erfolgreichen Therapie erklären. Dabei zeigt ein solcher Rückfall, dass die ursprüngliche CS-US-Assoziation noch gespeichert ist. Der präfrontale Cortex ist mit zwei Regionen beteiligt: Neurone im dorsalen anterioren cingulären Cortex (dACC) sind bei Furchtexpression und Furchtabruf aktiv; der dACC hemmt den ventromedialen präfrontalen Cortex (vmPFC). Dagegen werden Furchtextinktion und vor allem der Extinktionsabruf durch die Aktivität des vmPFC vermittelt, der regulierend wirkt: Er hemmt die Amygdala (und die Expression von Furcht), den dACC und begünstigt den erfolgreichen Abruf der Extinktion. Bei Patienten mit Angststörungen (s. Kapitel 2.2.7.), stressor- und trauma-bezogenen Störungen liegen u.a. Defizite im Extinktionsabruf vor und erfolgreiche Therapiekonzepte beruhen auf Extinktionslernen (vgl. [9]).
Das telencephale Schmerznetzwerk
Schmerz wird definiert als „unangenehme sensorische und emotionale Erfahrung, die mit tatsächlichen oder potenziellen Gewebeschädigung zusammenhängt oder in Begriffen einer solchen Schädigung beschrieben wird“ ([übersetzt] International Association for the Study of Pain, IASP, [11]). Die zugehörigen primären Sinneszellen, die Nozizeptoren, detektieren nicht Schmerz, sondern ausschließlich Gewebeschädigung, die durch intensive mechanische, thermische und/oder chemische Reize ausgelöst wird. Schmerz als (unangenehme) sensorische und emotionale Erfahrung entsteht erst im Gehirn (vgl. Kapitel 2.8.3.).
Es lassen sich verschiedene telencephale Komponenten von akutem Schmerz unterscheiden: die sensorisch-diskriminative Komponente, verarbeitet im primären (SI) und sekundären (SII) somatosensorischen Cortex, und die unmittelbare affektive Komponente, verarbeitet im anterioren cingulären Cortex (ACC) und der anterioren Inselrinde (AI) [7]. Interessanterweise sind die unmittelbaren affektiven Komponenten (ACC und AI) sowie SI und SII auch dann aktiviert, wenn Personen im Wortsinne mitfühlend (empathisch) Situationen verarbeiten, in denen anderen Personen nozizeptive Reize zugefügt werden oder andere Personen Schmerz mimisch ausdrücken. Mitgefühl (im neurobiologischen Kontext Empathie genannt) ist demnach ein „affektiver Zustand, verursacht dadurch, dass Emotionen oder sensorische Zustände einer anderen Person geteilt werden“ (übersetzt aus [12], S. 154). Eine Aktivation der Strukturen des emotionalen Schmerznetzwerks (dACC, AI) lässt sich auch durch sozialen Auschluss herbeiführen, dann auch als sozialer Schmerz bezeichnet [13].
2.1.3. Neurotransmitter und Verhalten
Während die Kommunikation innerhalb eines Neurons elektrische Signale nutzt, erfolgt die Kommunikation zwischen Neuronen in der Regel mit chemischen Botenstoffen (Neurotransmittern), die an den Axonterminalen des präsynaptischen Neurons freigesetzt werden und über den synaptischen Spalt die Rezeptoren in der postsynaptischen Membran erreichen. Neurotransmitter ändern das Ruhepotential der postsynaptischen Membran. Voraussetzung für die Wirkung eines Transmitters ist das Vorhandensein von Kalzium im präsynaptischen Neuron.
Transmitter sind eingeteilt in niedermolekulare Neurotransmitter (Aminosäuren, Aminosäurederivate [Monoamine], Acetylcholin), hochmolekulare Neuropeptide sowie in gasförmige Transmitter und Lipide s. Tabelle 3). Aminosäuretransmitter sind direkt verfügbar; Acetylcholin und Aminosäurederivate werden dagegen im Neuron aus Vorläufermolekülen gebildet: Dopamin und Noradrenalin aus Tyrosin und Serotonin aus Tryptophan. Die Inaktivierung von Neurotransmittern erfolgt über die Transporter-vermittelte Wiederaufnahme (engl. Reuptake) in die Präsynapse, über enzymatischen Abbau (so bei Acetylcholin), über Diffusion weg von der Synapse oder durch Bindung an Autorezeptoren in der präsynaptischen Membran.
Neuropeptide (bestehend aus bis zu 100 Aminosäuren) werden ebenfalls aus Vorläufermolekülen (langkettigeren Polypeptiden) im Soma des Neurons gebildet, an die synaptischen Endigungen transportiert und freigesetzt. Zu den Neuropeptiden zählen u.a. das Corticotropin-Releasing-Hormon (CRH), Endorphine, Neuropeptid Y (NPY), Orexin, Substanz P, Vasopressin und Oxytocin. Als Neuropeptide wirken auch peripher gebildete Peptidhormone wie die gastrointestinalen Peptidhormone Insulin, Leptin, Ghrelin und Cholecystokinin. Einen interessanten Zugangsweg für die direkte Verabreichung von Neuropeptiden in das ZNS und ihre Wirkung an den dortigen Rezeptoren stellt die intranasale Applikationsroute dar: Für eine Reihe von Peptiden (für Adrenocorticotropes Hormon [ACTH], Insulin und Vasopressin) konnte ein Anstieg der jeweiligen Spiegel in der Cerebrospinalflüssigkeit (CSF) nach intranasaler Applikation gezeigt werden.
ZNS-Wirkung haben natürlich auch die Steroidhormone (Glukokortikoide, Sexualhormone), die als lipophile Hormone direkt die Blut-Hirn-Schranke passieren (vgl. dazu Abschnitt 2.1.4.).
Neurotransmitter und -peptide sind an wichtigen Erlebens- und Verhaltensfunktionen beteiligt (s. Tabelle 3). Effekte psychoaktiver Substanzen lassen sich folgerichtig vorhersagen, wenn man ihre Wirkung als Agonisten vs. Antagonisten an Transmitterrezeptoren kennzeichnet, wie in Tabelle 4 für Alkohol, Nikotin, Kokain, Amphetamin, Ecstasy, Marihuana sowie Opiate (Morphin, Heroin) dargestellt.
|
Transmitterklasse |
Unterformen |
Physiologische Effekte und Erlebens-/ Verhaltenseffekte |
|
Niedermolekulare Neurotransmitter |
||
|
Aminosäuren |
• Glutamata • GABAb |
• Erregung, Langzeitpotenzierung, Gedächtnis • Angstreduktion, Entspannung, Erhöhung der Krampfschwelle |
|
Acetylcholin (ACh) |
• Quergestreifte Muskulatur: Kontraktion • Sympathisches NS: präganglionär; Parasympathisches NS: prä-/postganglionär • Lernen • Gedächtnisförderung • REM-Schlaf |
|
|
Aminosäurederivate |
• Dopamin (DA)
|
• Willkürmotorik • Belohnung und Sucht • Handlungsplanung |
|
|
• Noradrenalin (NA) |
• Sympathisches NS: postganglionär • Arousal und Vigilanz • Schlafreduktion • Appetitkontrolle • Stimmung/Befinden |
|
|
• Serotonin (5 HT) |
• Arousal • Schlaf-/Wachregulation • Appetitreduktion • Übelkeit • Stimmung (auch Kontrolle aggressiven, riskanten Verhaltens) |
|
Hochmolekulare Neuropeptide |
||
|
Neuropeptide (kleine Auswahl) |
• Endorphine • Orexin
• Substanz P |
• Schmerzreduktion, Wohlbefinden • ↑Nahrungsaufnahme; • Schmerzmodulation (Sensitivierung) |
|
Als Neuropeptide |
• Insulin
• Leptin |
• ↓Nahrungsaufnahme, • ↓Nahrungsaufnahme, |
|
Weitere (Lipide, Gasförmige Neurotransmitter) |
||
|
Lipide |
Endocannabinoide |
• Analgesie, Sedation, Appetitsteigerung, Konzentrations- und Gedächtnisdefizite |
|
Gasförmige |
Stickstoffmonoxid (NO) |
• Entspannung glatter Muskulatur in Gefäßen • Erektion |
a: weiterer exzitatorischer Transmitter: Aspartat; b: weiterer inhibitorischer Transmitter: Glycin.
|
Substanz |
Transmitterwirkung |
Erlebens-/Verhaltenseffekte |
|
Alkohol |
• nicht-kompetitiver Agonist am GABAA-Rezeptor |
• Angstreduktion |
|
• nicht-kompetitiver Antagonist am NMDA-Glutamatrezeptor |
• Gedächtnisdefizite |
|
|
• stimuliert dopaminerges System |
• Euphorie, Sucht |
|
|
Nikotin |
• stimuliert nikotinerge ACh-Rezeptoren |
• Wachheit; kognitive Leistungssteigerung |
|
• stimuliert DA-Rezeptoren im Nucleus accumbens |
• Sucht |
|
|
Kokain |
• DA Reuptake-Hemmer |
• Euphorie, Erregung |
|
Amphetamin |
• DA und NA Reuptake-Hemmer • stimuliert DA und NA Freisetzung |
• Wachheit, Appetitunterdrückung |
|
Ecstasy (MDMA) |
• stimuliert 5-HT Freisetzung |
• Wachheit, Appetitunterdrückung |
|
Marihuana |
• stimuliert Cannabinoid (CB1)-Rezeptoren |
• milde Euphorie, Halluzinationen, |
|
Morphin, Heroin |
• stimuliert µ- und δ-Opiat-Rezeptoren |
• Schmerzreduktion, Euphorie, Relaxation |
Abkürzungsverzeichnis: ACh: Acetylcholin; DA: Dopamin; GABA: Gamma-Aminobuttersäure; 5-HT: 5-Hydroxytryptamin (Serotonin); NMDA: N-Methyl-D-Aspartat; NA: Noradrenalin; NO: Stickstoffmonoxid; NS: Nervensystem; REM: rapid-eye-movement.
2.1.3.1. Glutamat
Glutamat ist der wichtigste und am weitesten verbreitete exzitatorische Transmitter im ZNS. Alle sensorischen Neuronen (außer Nozizeptoren) übermitteln ihre Informationen über Glutamat bzw. über seine Wirkung an dem glutamatergen Rezeptor NMDA (N-Methyl-D-Aspartat) und AMPA-Rezeptor. Glutamat ist auch der für die Langzeitpotenzierung (LTP) entscheidende Transmitter. Ein (zu) hohes Aufkommen von Glutamat nach dem für die NMDA-Wirkung notwendigen, aber zu starken Eintritt von Calcium in das Neuron kann aber auch sog. exzito-toxische Effekte auf Neuronen haben.
Klinik: Vor diesem Hintergrund ist zu verstehen, dass NMDA-Antagonisten (z.B. Memantin) bei Patienten mit einer Demenz vom Alzheimer-Typ verwendet werden, um einer exzito-toxischen Wirkung von Glutamat auf die nur noch wenigen cholinergen Neuronen entgegenzuwirken [7].
2.1.3.2. Gamma-Amino-Buttersäure (GABA)
GABA ist der wichtigste inhibitorische Transmitter. Etwa 50% der Neuronen im ZNS sind GABA-erg, insbesondere im cerebralen Cortex, limbischen System und Hypothalamus. Der GABA-Rezeptor hat ionotrope Rezeptoren (GABAA GABAC) mit einem Chlor-Kanal (Cl-Kanal) und einen metabotropen (GABAB) Rezeptor. GABA hat anxiolytische Effekte und senkt die Konzentration von CRH. Es entspannt die Muskulatur und ist krampflösend (antikonvulsiv), was den Einsatz seiner Agonisten bei Epilepsie begründet.
Klinik: Bei Angststörungen (s. Kapitel 2.2.7.) liegt u.a. eine verminderte GABA-erge Aktivität vor. Dämpfende Psychopharmaka (Benzodiazepine, Tranquilantien, Barbiturate) und auch Alkohol wirken als nicht-kompetitive Agonisten am GABAA-Rezeptor. Zu den unerwünschten psychischen Nebenwirkungen von Benzodiazepinen gehören Sedierung, Lern- und Gedächtnisdefizite, das Wiederauftreten der Angst (durch Herunterregulieren der GABAA-Rezeptoren) sowie Substanzabhängigkeit.
2.1.3.3. Acetylcholin
Acetylcholin (ACh) hat vielfältige funktionelle Bedeutung im NS. Jede Kontraktion der quergestreiften Muskeln entsteht durch Freisetzung von ACh an der motorischen Endplatte. Im autonomen NS wirkt ACh als präganglionärer Überträgerstoff des sympathischen und des parasympathischen Systems und als postganglionärer Überträgerstoff des parasympathischen NS. Im Gehirn hat ACh wichtige Funktionen für Aufmerksamkeit, Schlaf, Lernen und Gedächtnis durch Aktionen in folgenden Gebieten:
- Cholinerge Neuronen in der dorsolateralen Brücke sind für die Auslösung der meisten Charakteristika des REM-Schlafs (s. Kapitel 2.2.2.) wichtig, wobei die cholinerge Aktivität im REM-Schlaf erhöht ist.
- Cholinerge Neuronen im Septum stützen elektrophysiologische Rhythmen im Hippocampus und sind damit für Gedächtnisprozesse bedeutsam.
- Im basalen Vorderhirn lokalisierte cholinerge Rezeptoren sind für Lern- und Gedächtnisprozesse relevant und eingebunden in die Aktivierung des cerebralen Cortex, die Bahnung von Lernvorgängen und sog. perzeptuelles Lernen [7].
Klinik: bei Patienten mit Alzheimer-Demenz sind cholinerge Neuronen besonders schnell von Degeneration betroffen. Eine Form der pharmakologischen Behandlung ist deshalb die Gabe von Acetylcholinesterase-Hemmern, also Substanzen, die den ACh-Abbau hemmen.
2.1.3.4. Dopamin
Dopamin (DA) hat ebenfalls vielfältige, sowohl exzitatorische als auch inhibitorische Effekte im ZNS – je nach postsynaptischem Rezeptortyp (D1 bis D6). Es ist einbezogen in Prozesse der Handlungsplanung und -kontrolle, in die Steuerung der Willkürmotorik und von Belohnungsmechanismen. Die wichtigsten dopaminergen Verschaltungen im Gehirn sind der a) nigrostriatale, b) mesolimbische und c) mesocorticale Pfad [7] (s. auch https://commons.wikimedia.org/wiki/File:Dopamine_Pathways.png).
a) Der nigrostiatale Pfad
Der nigrostiatale Pfad umfasst die Substantia nigra und das dorsale Striatum. Hier ist Dopamin für die Abstimmung zwischen motorikhemmenden (D2-vermittelten) und motorikfördernden (D1-vermittelten) Impulsen, also für die Steuerung der Willkürmotorik und Handlungskontrolle bedeutsam.
Klinik: Bei Defiziten in der Bildung von Dopamin in der Substantia nigra ist die Abstimmung motorikfördernder und motorikhemmender Impulse gestört (Parkinson-Erkrankung, s. 2.1.2.5. Abschnitt Basalkerne).
b) Das mesolimbische System
Das mesolimbische System, das vom VTA im Mittelhirn zum Nucleus accumbens, der Amygdala, dem Hippocampus, dem präfrontalen Cortex, Bulbus olfactorius und auch zum Septum projiziert, ist in Belohnungsprozesse einbezogen, auch solche, die bei Konsum suchterzeugender Substanzen oder nicht-substanzgebundener (s. Kapitel 2.2.6.) Süchte auftreten. So zeigt sich tierexperimentell bei (Selbst) Applikation verschiedener Drogen (z.B. von Nikotin, Kokain, Amphetamin, Heroin, Cannabinoiden) eine Erhöhung des Dopaminspiegels im Nucleus accumbens. Eine gesteigerte Aktivierung im Nucleus accumbens lässt sich auch beim Menschen infolge suchterzeugender Substanzen und auch nicht-substanzgebundener Verstärker (z.B. Geldgewinn) zeigen.
c) Das mesocorticale System
Das mesocorticale System umfasst die Verbindung zwischen VTA und Gebieten des präfrontalen Cortex. Dopamin nimmt über diesen Weg Einfluss auf höhere kognitive Funktionen wie Handlungsplanung und -kontrolle.
Klinik: Veränderungen in der Aktivität im dopaminergen System liegen u.a. bei der Schizophrenie vor, und zwar im Sinne einer gesteigerten dopaminergen Aktivität im Nucleus accumbens (was mit den Positivsymptomen der Schizophrenie in Verbindung gebracht wird) und einer verminderten dopaminergen Aktivität im präfrontalen Cortex. Sog. Pharmaka der dritten Generation wie Aripiprazol [7] setzen hier an und wirken gleichzeitig als Dopamin-Antagonist im Nucleus accumbens und als partieller Dopamin-Agonist im präfrontalen Cortex.
2.1.3.5. Noradrenalin
Der Locus coeruleus im Pons ist der Ursprungsort der meisten noradrenergen Neuronen. Noradrenalin wirkt in der Periphere als Überträgerstoff an den postganglionären Neuronen des Sympathikus und ist u.a. für die frühe Komponente der Stressreaktion (s. Abschnitt 2.1.4.) bedeutsam. Noradrenalin hat im ZNS sowohl exzitatorische als auch inhibitorische Effekte, je nach Rezeptorsubtyp und Projektionsgebiet. NA steigert die Vigilanz (Aufmerksamkeit auf selten auftretende Ereignisse), führt zu erhöhtem Arousal, Wachheit bzw. Verminderung von Schlaf, Appetitkontrolle und zur Förderung des Gedächtnisses, insbesondere für emotionale Reize.
2.1.3.6. Serotonin (5-Hydroxytryptamin = 5 HT)
Das höchste Vorkommen serotonerger Neuronen im ZNS findet sich in den Raphé-Kernen. Projektionen gehen sowohl ins Rückenmark als auch in den Hippocampus und die Amygdala, in das Kleinhirn, den Thalamus und den gesamten Neocortex. Serotonin ist eingebunden in die Schlaf-Wach-Regulation, wobei Serotoninspiegel bei Wachheit höher sind als in allen Schlafstadien [7]. Die Bedeutung für emotionales Befinden zeigt sich u.a. darin, dass Serotoninmangel bei Depression und Angst, aber auch bei erhöhter Risikobereitschaft und Aggression vorliegt. Serotonin-Reuptake-Hemmer werden entsprechend in der Therapie von Angststörungen und Depression verabreicht (5-HT1-Rezeptoren). Serotonin führt zudem zu einer Abnahme der Nahrungsaufnahme (5-HT2-Rezeptoren). Im Magen-Darm-Trakt und zentralnervös (an chemorezeptiven Triggerzonen und dem emetischen Zentrum) dient Serotonin als Auslöser von Übelkeit (5-HT3-Rezeptoren).
Neuropeptide
Beispielhaft werden hier die Wirkung von Endorphinen und Orexin dargestellt. Endorphine wirken als körpereigene Opiate und aktivieren Opiatrezeptoren, wodurch Schmerz vermindert wahrgenommen wird. Sie werden u.a. in Notfallsituationen ausgeschüttet und erlauben es so – trotz ggf. extrem starker nozizeptiver Reize – zu flüchten. Orexin wird im lateralen Hypothalamus nach Stimulation durch NPY- und AGRP-produzierende (engl. agouti-related protein) Neuronen gebildet, regt die Nahrungsaufnahme an, vermindert die Energieverausgabung und steigert Wachheit.
Auch periphere Peptidhormone wirken im ZNS als Neuropeptide, hier exemplarisch beschrieben für Insulin, das in der Peripherie anabole Effekte auf den Glukose-, Protein- und Fettstoffwechsel hat, indem Energievorräte angelegt werden. Grundlage für zentralnervöse Wirkungen von Insulin sind Rezeptoren im ZNS. So befinden sich Insulinrezeptoren im Riechkolben, im Nucleus arcuatus des Hypothalamus, im Hippocampus, in der Amygdala, im VTA des Mittelhirns und in präfrontalen corticalen Arealen. In Tier- und Humanstudien wurden einzelne der nachfolgenden Effekte gefunden (im Humanbereich häufig durch intranasale Gabe): Im ZNS fungiert Insulin als Sättigungs- und Adipositassignal (für viszerales Körperfett) und wirkt katabol, indem eine Abnahme der Nahrungsaufnahme (bei nicht-übergewichtigen und insbesondere männlichen Organismen) und ein Anstieg der Energieverausgabung induziert wird. Es zeigen sich auch Effekte auf die Prozessierung olfaktorischer Reize und gedächtnisfördernde Effekte, Veränderungen des Befindens und eine Erhöhung des Belohnungswerts von Nahrung. Über präfrontale Areale übt zentrales Insulin inhibitorische Kontrolle auf die Nahrungsaufnahme aus.
2.1.4. Hormone und Verhalten
2.1.4.1. Funktion, Einteilung und Produktionsorte von Hormonen
Das Hormonsystem ist ebenso wie das NS und das Immunsystem ein wichtiges Kommunikationssystem des Körpers. Es hat wichtige Funktionen im Rahmen der Herstellung des physischen und psychischen Gleichgewichts (Homöostase) und veranlasst Regulation, wenn Parameter vom Sollwert abweichen. Auf diese Weise wirken Hormone auf den Stoffwechsel oder die Energieverausgabung und über Rezeptoren im ZNS auch auf komplexe Verhaltensweisen (wie Sexualität, Essverhalten, Stressreaktion und Emotionen). Hormone werden von spezifischen Zellen synthetisiert, im Regelfall ins Blut sezerniert und können über den Blutkreislauf fast jeden Ort des Körpers erreichen. Sie entfalten ihre Wirkung über Rezeptoren, die sich entweder in der Membran der Zielzelle (nicht-genomische Effekte von hydrophilen Hormonen) oder dem Zellkern (genomische Effekte von lipophilen Hormonen) befinden. Mittlerweile ist bekannt, dass auch lipophile Steroidhormone nicht-genomische Effekte auslösen.
Nach ihrer chemischen Struktur werden Hormone in Peptidhormone, Aminosäurederivate, Steroidhormone und Fettsäurederivate aufgeteilt. Zu den hydrophilen Peptidhormonen zählen u.a. Insulin, Glucagon und Pro-opiomelanocortin (POMC) (als Vorläufermolekül für ACTH, Endorphine und α-Melanozytenstimulierendes Hormon [MSH]) (zu Aminosäurederivaten s. Abschnitt 2.1.3.). Sämtliche Steroidhormone (Glukokortikoide, Mineralkortikoide, Sexualhormone) sind lipophile Hormone und stammen vom Cholesterin ab. Zu den Fettsäurederivaten zählt Prostaglandin, was als Gewebehormon nicht über den Blutkreislauf, sondern unmittelbar auf das umgebende Zellgewebe (parakrin) wirkt.
Steuerzentrale für die Freisetzung von Hormonen im ZNS ist der Hypothalamus (vgl. 2.1.2.4.). Hier werden u.a. Releasing- und Inhibiting-Hormone freigesetzt. Funktionelle Bedeutung der hypothalamischen Releasing-Hormone ist die Anregung der Freisetzung von Hormonen in der Hypophyse – so führt Corticotropin-Releasing-Hormon (CRH) zur Freisetzung von Adrenocorticotropem Hormon (ACTH) und Gonadotropin-Releasing-Hormon (GnRH) initiiert die Freisetzung der Gonadotropine (follikelstimulierendes Hormon [FSH] und luteinisierendes Hormon [LH]) aus dem HVL. Inhibiting-Hormone dagegen hemmen die nachfolgende Freisetzung eines Hormons (so Somatostatin, das die Freisetzung von Wachstumshormon im HVL hemmt). Im HVL werden vor allem glandotrope Hormone freigesetzt, die ihrerseits die Freisetzung von Hormonen aus dem Drüsengewebe (glandulärem Gewebe) in der Peripherie veranlassen: ACTH veranlasst die Freisetzung von Cortisol aus der Nebennierenrinde. Gonadotropine regen die Bildung von Sexualhormonen in den Keimdrüsen an (also von Östrogen aus den Ovarien bei Frauen und von Testosteron aus den Hoden bei Männern). Thyreoidstimulierendes Hormon (TSH) führt zur Bildung von Thyroxin und Trijodthyronin in der Schilddrüse. Wachstumshormon und Prolaktin wirken direkt als effektorische Hormone. Im HHL werden Vasopressin (= antidiuretisches Hormon [ADH]) und Oxytocin aus den Endknöpfen der Neuronen des hypothalamischen Nucleus supraopticus sezerniert und sind als effektorische Hormone wirksam.
2.1.4.2. Stress
Die Bedeutung von Hormonen für psychische Funktionen lässt sich sehr gut anhand der Veränderungen darstellen, die im Rahmen einer Stressreaktion auftreten. Stress umfasst zum einen den auslösenden Reiz (Stressor), die Bewältigungsversuche im Umgang mit dem Reiz (inkl. Einschätzung des Reizes (s. Kapitel 3.2.) als relevant oder irrelevant, günstig oder belastend sowie die Abschätzung der persönlichen körperlichen, materiellen und sozialen Ressourcen für die Bewältigung) und die eigentliche Stressreaktion (vgl. auch [15]). Stress lässt sich definieren als „aktuelle oder erwartete Störung der Homöostase oder einer erwarteten Bedrohung des Wohlbefindens“ (übersetzt aus [16], S. 397). Stresshormone haben efferente Funktionen, wirken aber auch afferent auf Strukturen des ZNS, was wichtige Erlebens- und Verhaltenseffekte herbeiführt. Störungen des Stresssystems sind beteiligt an psychischen und auch körperlichen Erkrankungen. Dabei hat die sog. akute Stressreaktion eine wichtige Anpassungsfunktion; die anhaltende chronische Stressexposition dagegen hat eher nicht-adaptive Konsequenzen (s. Kapitel 2.2.7.).
Efferente Anteile
Die Stressreaktion dient der Wiederherstellung des physischen und psychischen Gleichgewichts. Sie besteht aus zwei Anteilen unterschiedlicher zeitlicher Dynamik: der frühen Stressreaktion (engl. first wave), vermittelt über eine schnelle neuronale Aktivation der sympathiko-medullären Achse, und der verzögerten Komponente (engl. second wave) mit Aktivation der HHNA (s. Abbildung 4A). Zu den Veränderungen der frühen Phase (engl. first wave) der Stressreaktion gehören neben dem Anstieg der sympathischen Aktivität und der Freisetzung von Adrenalin und Noradrenalin aus dem Nebennierenmark auch die schnelle Freisetzung der Monoamine Dopamin, Noradrenalin und Serotonin im Gehirn (mit unmittelbaren synaptischen Wirkungen), die gesteigerte Freisetzung von Corticotropin-Releasing-Hormon (CRH) aus dem Hypothalamus, nicht-genomische Effekte zentraler Glukokortikoide, die gesteigerte Freisetzung von Endorphinen (mit Abnahme der Schmerzempfindung), von Endocannabinoiden und die reduzierte Freisetzung von GnRH aus dem Hypothalamus. Zeitlich verzögert (engl. second wave) werden im Zuge der Aktivierung der HHNA und der Freisetzung von CRH im Hypothalamus nun über den Blutweg ACTH im HVL und Glukokortikoide aus der Nebennierenrinde freigesetzt. Die Freisetzung von Sexualhormonen aus Ovarien und Testes wird vermindert.
Afferente Funktion von Stresshormonen
Ein wichtiges Merkmal von Stresshormonen ist, dass sie ihrerseits auch afferent auf das Gehirn zurückwirken (s. Abbildung 4B): Noradrenalin kann die BHS nicht passieren, wirkt aber indirekt über die Aktivation des Nervus vagus, was die monoaminerge Aktivität im Gehirn erhöht. Lipophile Glukokortikoide können die BHS passieren und wirken nach Beendigung des Stressors über negative Feedbackschleifen auf Glukokortikoidrezeptoren (GRs) zurück, was die weitere Freisetzung von CRH (Hypothalamus), von ACTH (Adenohypophyse) und damit auch von Cortisol aus der Nebennierenrinde begrenzt (s. Abbildung 4A).
Der Schwerpunkt bei der Untersuchung der afferenten Wirkung von Glukokortikoiden auf das Gehirn lag zunächst auf Hypothalamus und Hypophyse. Aber GRs und auch MRs (deren Affinität für Glukokortikoide sogar höher ist als die von GRs) befinden sich nicht nur in diesen klassischen Schaltstellen der zentralnervösen Regulation der Hormonfreisetzung, sondern auch in der Amygdala, dem Hippocampus und dem präfrontalen Cortex. Daraus ergibt sich, dass Stress (über die Aktion an GRs und MRs) auch auf die neuronalen Schaltkreise wirkt, die in Emotionen, Gedächtnis und präfrontale Handlungskontrolle eingebunden sind. So ist etwa bei hohen Cortisolspiegeln durch akuten Stress ein schlechterer Abruf bereits konsolidierter Gedächtnisinhalte zu erwarten – was etwa in Prüfungssituationen bedeutsam werden kann. Bei chronischem Stress sind u.a. Gedächtnisdefizite und eine Abnahme präfrontaler Handlungskontrolle zu erwarten (s. Kapitel 2.2.4.). In denselben Regionen sind z.B. auch Rezeptoren für Sexualhormone (z.B. für 17-b Östradiol [E2]) vorhanden, was u.a. erklärt, dass Emotion, Gedächtnis und Entscheidungsfindung auch über die verschiedenen hormonellen Zustände des weiblichen Menstruationszyklus variieren [17].
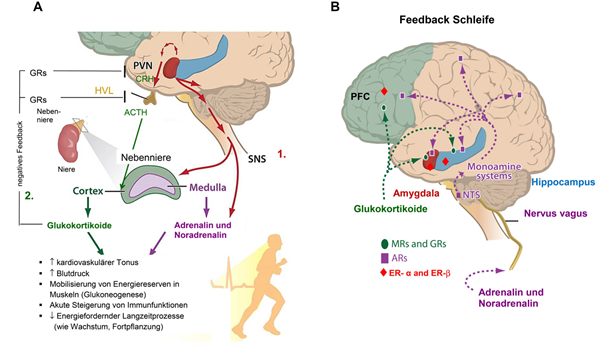
4A: Die Stressreaktion. 1. Schnelle (engl. first wave), über das SNS vermittelte Innervation des Nebennierenmarks mit Freisetzung von Adrenalin und Noradrenalin und 2. zeitlich verzögerte spätere Aktivation der Hypothalamus-Hypophysen-Nebennierenrinden-Achse mit Freisetzung von CRH (Corticotropin-Releasing-Hormon) aus dem PVN (paraventrikulären Kern) des Hypothalamus, Freisetzung von ACTH (Adrenocorticotropes Hormon) aus dem HVL (Hypophysenvorderlappen) und Glukokortikoiden (beim Menschen Cortisol) aus der Nebennierenrinde (engl. second wave). Ergänzend eingefügt zu [18] auch die negative Rückkopplung durch Cortisol an GRs (Glukokortikoidrezeptoren) im PVN und im HVL.
4B: Afferente Signale der Stresshormone an Amygdala, Hippocampus und Präfrontalen Cortex (PFC) durch vagal vermittelten Anstieg der zentralen Monoamine und über Wirkung von Glukokortikoiden an GRs und Mineralkortikoidhormonen an MRs (Mineralkortikoidrezeptoren). ARs: adrenerge Rezeptoren;NTS: Nucleus tractus solitarii; SNS: sympathisches Nervensystem. Ergänzend zu [18] eingefügt: Lokalisation der ERs: Östrogenrezeptoren
2.1.4.3. Klinische Aspekte und Stress über die Lebensspanne
Die Cortisolausschüttung unterliegt einer circadianen Rhythmik mit dem Maximum der Ausschüttung kurz nach dem Aufwachen, einer dann schnell eintretenden Abnahme und stabilen Werten (sofern keine Stressbedingung vorliegt) über den Tagesverlauf. Bei Erkrankungen, die mit chronischem Stress assoziiert sind, und auch bei Erkrankungen des Immunsystems liegen Veränderungen dieser Tagesrhythmik vor.
Es gibt empirische Evidenz, dass die späteren Antwortmuster der HHNA schon durch pränatale Stresseinwirkungen „programmiert“ werden und dadurch die weitere Reagibilität der Stressachse über die Lebensspanne modifizieren. Lupien, McEwen, Gunnar und Heim [19] unterscheiden in ihrem „life cycle model of stress“ dabei zwischen der pränatalen programmierenden Phase, der postnatalen differenzierenden Phase, der potenzierenden/inkubierenden Phase im Jugendalter und der aufrechterhaltenden/manifestierenden Funktion in Erwachsenenalter und Alter: Eine pränatale Stressexposition hat danach programmierende Effekte im Sinne einer gesteigerten Reagibilität der HHNA. Je nach Intensität der Stresserfahrung in der postnatalen Phase und frühen Kindheit erfolgt dann eine Differenzierung in eine gesteigerte GC-Freisetzung (bei „normalen“ Stressoren) und eine stark reduzierte GC-Freisetzung (bei sehr traumatischen Reizen). Im Jugendalter kommt es zu einer noch deutlicheren Differenzierung der Reaktionsmuster mit stark erhöhter vs. reduzierter Cortisolausschüttung. Schließlich manifestieren sich die psychischen Folgen der Reaktionsmuster infolge der erhöhten Cortisolausschüttung als Depression im Erwachsenenalter und als kognitiver Abbau im Alter. Die stark verminderte Cortisolausschüttung ist langfristig mit PTBS assoziiert. Wie aufgrund der Lokalisation zentraler GRs und MRs zu erwarten, hat chronischer Stress nicht nur Effekte auf die HHNA, sondern führt zu strukturellen Veränderungen in Amygdala, Hippocampus und präfrontalem Cortex und damit zu Veränderungen von Emotionen, Gedächtnis sowie Handlungskontrolle und Emotionsregulation.
2.1.5. Autonomes Nervensystem und Verhalten
Das autonome (oder auch viszerale) Nervensystem (ANS) stellt die Verknüpfung zwischen Körperorganen und Nervensystem dar. Es erhält Afferenzen von und sendet Efferenzen an die inneren Organe (Viscera, „Eingeweide“), d.h. an die glatte Muskulatur der inneren Organe und Gefäße, an die Muskulatur des Herzens, an die Drüsen und auch die Lymphknoten (nur sympathisch innerviert). Eine der wesentlichen Funktionen besteht in der Konstanthaltung des inneren Milieus hier über den schnellen neuronalen Weg. Das ANS hat auch wichtige Funktionen bei psychologischen (insbesondere emotionalen) Prozessen.
Die Anteile des ANS sind das sympathische und das parasympathische Nervensystem. Hinzu kommt das Darmnervensystem (enterisches, intramurales Nervensystem). Wie von Schandry [15] ausgeführt, wurde der Begriff des „sympathischen Systems“ (gr. sympathein, „mitempfinden“) schon in den Schriften von Homer (8. Jahrhundert v.Chr.) benutzt, um Gefühle und Empfindungen in Bezug zu Prozessen in den inneren Organen zu kennzeichnen. Der Begriff „autonomes Nervensystem“ und die Unterscheidung in Sympathikus und Parasympathikus wurde von Langley (1852–1925) eingeführt (vgl. [15]), der auch das Darmnervensystem schon als dritte, eigenständige Komponente abgrenzte. Der Begriff „autonom“ will verdeutlichen, dass die Regulation der körperlichen Funktionen (z.B. Atmen, Blutdruckregulation) im Regelfall ohne bewusste Kontrolle erfolgt. Dies bedeutet aber nicht, dass die Funktionen nicht auch bewusst wahrgenommen oder willkürlich gesteuert werden können (vgl. [14]): So kann z.B. mentale Entspannung zu einer Veränderung der Herztätigkeit beitragen oder vegetative Funktionen lassen sich durch die Methode des Biofeedback verändern: Biofeedback besteht darin, dass die Ausprägung eines physiologischen Parameters, der nicht unmittelbar der bewussten Wahrnehmung zugänglich ist (etwa Höhe des Blutdrucks; Grad der Konstriktion peripherer Gefäße), durch ein apparatives System rückgemeldet wird. So wird beispielsweise – zur Behandlung des Migräneschmerzes – die Weite der Temporalis-Arterie durch Messfühler aufgenommen, digitalisiert und auf einem Computerbildschirm rückgemeldet: der Patient/die Patientin erlernt, die Dehnung der Gefäße zu reduzieren (sog. Vasokonstriktionstraining). Dabei werden auch Lernmechanismen (s. Kapitel 2.2.3.) des sog. instrumentellen Lernens wirksam: die Vasokonstriktion führt zu einer Abnahme des Schmerzes. Lernpsychologisch wird hier negative Verstärkung wirksam, was das Verhalten (= Ausüben des Trainings) erhöht.
|
Sympathikus-Wirkung |
Erfolgsorgan |
Parasympathikus-Wirkung |
|
Pupillenerweiterung |
Auge (Pupille)
Drüsen |
Pupillenverengung, Akkomodation |
|
0 |
• Tränendrüse |
↑ Sekretion |
|
↑ Sekretion ↓ Sekretion, Sekreteindickung 0 Freisetzung NA, A |
• Schweißdrüsen • Speicheldrüsen
• Magen-/ Darmdrüsen • Nebennierenmarka |
0 ↑ Sekretion, Sekretverdünnung ↑ Sekretion 0 |
|
|
Herz |
|
|
↑ ↑ Geschwindigkeit ↑ |
• Pulsfrequenz • Erregungsleitung • Kontraktionskraft
|
↓ ↓ Geschwindigkeit 0 |
|
Konstriktion Dilatation Konstriktion Dilatation 0 |
Blutgefäße • Gastrointestinaltrakt • Skelettmuskulatur • Haut • Herz • Penis/Klitoris
|
Dilatation 0 0 0 Dilatation |
|
Dilatation ↓ Sekretion |
Lunge • Bronchialmuskulatur • Bronchialdrüsen |
Konstriktion ↑ Sekretion |
|
|
Magen/Darm-Trakt |
|
| ↓ |
• Motilität |
↑ |
|
Kontraktion - Verschluss |
• Sphinktermuskeln |
Dilatation - Öffnung |
|
|
Harnblase |
|
|
0 |
• Wandmuskulatur |
Kontraktion: Blasenentleerung |
|
Kontraktion: Blasenverschluss |
• Schließmuskeln |
0 |
|
Ejakulation |
Penis |
Erektion |
Anmerkung: a: Unter dem Einfluss des Sympathikus erfolgt die Freisetzung von Noradrenalin als Transmitter. Transmitterwirkung bedeutet auch: Es kommt zu einem schnellen Abbau im synaptischen Spalt. Die Freisetzung des Hormons Noradrenalin hat eine längere Wirkung über den Blutweg und kann so die Reaktionen der sympathisch innervierten Organe verlängern. Abkürzungsverzeichnis: A: Adrenalin, NA: Noradrenalin.
Das ANS ist nicht nur ein efferentes System, sondern sendet zahlreiche viszerale Afferenzen ins ZNS, etwa Informationen zur Dehnung der Gefäße und glatten Muskulatur oder zur Gewebeschädigung. Lange bestand die Annahme, dass der Hypothalamus die oberste Steuerzentrale für vegetative Reaktionen ist. Mittlerweile ist bekannt, dass ein Netzwerk im ZNS für die Regulation vegetativer Reaktionen zuständig ist (das sog. engl. central autonomic network) (vgl. [15]). Seine Bestandteile sind die Amygdala, das Septum, Teile der Basalkerne, die Inselrinde und Strukturen in der Medulla oblongata.
Fast alle Organe werden sowohl sympathisch und als auch parasympathisch innerviert (vgl. Tabelle 5). Die Aktivität des ANS ist eng auch mit psychischen, insbesondere emotionalen Prozessen verbunden. Das sympathische Nervensystem wird vor allem durch externe Gefahrenreize bzw. bei erhöhter körperlicher und/oder mentaler Anforderung bzw. in Stresssituationen aktiviert. Seine Tätigkeit ermöglicht Kampf- und Fluchtreaktionen (engl. fight and flight) und verbraucht Energie. Das parasympathische System wird durch interne Reize (wie Eintritt von Nahrung in den Magen-Darm-Trakt) aktiviert; zu den Aufgaben zählt die Wiederherstellung von Energiereserven (engl. rest and digest). Sympathikus und Parasympathikus arbeiten einerseits gegensinnig (funktioneller Antagonismus), sie wirken aber auch funktionell synergistisch: Ggf. sind beide Systeme auch gleichzeitig aktiv: Bei starkem Stress wird sowohl das sympathische Nervensystem (Herzrasen, Schwitzen) als auch das parasympathische Nervensystem (Harn- und Stuhldrang) aktiviert.
Die Wirkung am jeweiligen Erfolgsorgan hängt dabei ab vom postganglionär freigesetzten Überträgerstoff (NA im sympathischen und ACh mit Wirkung an muskarinergen Rezeptoren im parasympathischen System) sowie im sympathischen System vom jeweiligen adrenergen Rezeptortyp (α1, α2, β1, β2). Auch sind Kotransmitter (NO, NPY, vasoaktives Peptid und auch Endorphine) beteiligt. Beide Systeme nutzen auf dem Weg vom ZNS zum Zielorgan im Unterschied zum somatischen Nervensystem nicht eines, sondern zwei Neurone: das präganglionäre Neuron (mit Zellkörper im ZNS) und das postganglionäre Neuron außerhalb des ZNS, das vom Ganglion zum Zielorgan zieht. Die präganglionären Neurone des sympathischen Nervensystems befinden sich zwischen Ende des Zervikalmarks (C8) und zweitem Lumbalsegment (L2); die sympathischen Ganglien liegen als sympathischer Grenzstrang direkt neben der Wirbelsäule (paravertebral). Das ermöglicht die schnelle synchrone Innervation der Zielorgane – die Effekte erreichen alle Organe zeitgleich. Die Neurone des parasympathischen Nervensystems liegen präganglionär um das sympathische Nervensystem herum (para) zum einen im Hirnstamm (wo sie zu den Hirnnervenkernen III, V, IX und X ziehen) und zum anderen im Sakralmark des Rückenmarks; die parasympathischen Ganglien befinden sich organnah. Die Übertragung ist langsamer und weniger synchron als im sympathischen System.
Zu den Aufgaben des weitgehend unabhängig arbeitenden Darmnervensystems gehört die Anregung der Darmtätigkeit und von Absorptions- und Sekretionstätigkeiten; es erhält aber auch modulierende Zuflüsse vom sympathischen und parasympathischen System. Zudem liegen tierexperimentelle Daten vor, wonach Darmbakterien (Darmflora) auch Einfluss auf Verhalten (etwa Lernprozesse) nehmen; in diesem Zusammenhang wird auch der Begriff der Darm-Hirn-Achse (engl. gut-brain-axis) verwendet. So ging im Tierexperiment die Unterdrückung der bakteriellen Besiedlung des Darms nach Antibiotikagabe mit Lerndefiziten bei der Furchtkonditionierung einher (vgl. [15]). Auch für den Humanbereich liegen Hinweise auf kognitive Effekte vor.
2.1.6. Immunsystem und Verhalten
Aufgabe des Immunsystems (IS) ist es, den Körper vor Eindringlingen von außen (Viren, Bakterien, Pilze, Parasiten) zu schützen und auch unkontrolliert wachsende Zellen des eigenen Körpers (z.B. Tumorzellen) zu kontrollieren. Das IS erkennt körperfremde und veränderte körpereigene Stoffe. Die Bildungsstellen immunkompetenter Zellen (= primäre lymphatische Organe), sind der Thymus (Bildung von T-Lymphozyten) und das Knochenmark (engl. bone marrow, Bildung von B-Lymphozyten).
|
|
Unspezifisches (angeborenes) IS |
Spezifisches (adaptives) IS |
||
|
Zellulär
|
• Monozyten • Makrophagen • Granulozyten (neutrophile und eosinophile) • NK-Zellen |
• T-Lymphozyten • Zytotoxische T-Zellen |
||
|
Humoral |
• Akute-Phase-Proteine • Komplementsystem • Enzyme • von Zellen des unspezifischen IS gebildete Zytokine |
• Antikörper (IgA, IgD, IgE, IgG, IgM) • von Zellen des spezifischen IS gebildetete Zytokine (z. B. IL-2) |
||
|
|
|
|
||
Abkürzungsverzeichnis: Ig: Immunglobulin; IL: Interleukin; IS: Immunsystem; NK-Zellen: Natürliche Killer-Zellen; TNF: Tumornekrosefaktor
Die Reaktionsorte des Immunsystems (= sekundäre lymphatische Organe) sind die Milz und die über den Körper verteilten Lymphknoten. Die Parameter des Immunsystems sind eingeteilt in zelluläre und humorale Parameter, jeweils unterschieden in unspezifische und spezifische Komponenten (s. Tabelle 6). Unspezifische Abwehrmechanismen erfordern keine immunologische Gedächtnisbildung, treten schnell (innerhalb von Minuten bis Stunden) ein und erfolgen über das angeborene Immunsystem. Die spezifischen Abwehrmechanismen sind erworben und somit adaptiv und treten mit zeitlicher Verzögerung ein.
Das Immunsystem ist in vielfacher Weise in Verhalten und Erleben eingebunden. Grundlage dafür ist die jeweils bidirektionale Kommunikation zwischen IS und dem ZNS respektive dem PNS sowie die Kommunikation zwischen IS und ES (vgl. [21]). Diese Kommunikation wird u.a. durch folgende Voraussetzungen ermöglicht:
- Lymphatische Organe (Thymus, Knochenmark, Milz, Lymphknoten) werden durch das ANS innerviert, nämlich durch noradrenerge Fasern des sympathischen Nervensystems.
- Zellen des Immunsystems (T- und B-Lymphozyten, NK-Zellen, Monozyten und Makrophagen) haben Rezeptoren für Neurotransmitter (Acetylcholin, Noradrenalin), Neuropeptide (z.B. Endorphine, Substanz P, NPY, vasoaktives Peptid) und für Hormone (z.B. Noradrenalin, Adrenalin, Cortisol, Wachstumshormon, Prolaktin).
- Proinflammatorische Zytokine – als humorale Botenstoffe des Immunsystems – wirken nicht nur auf Zellen des Immunsystems, sondern fungieren als afferente Signale an das ZNS. Insbesondere untersucht sind die proinflammatorischen Zytokine Interleukin (IL)-1 und Tumornekrosefaktor (TNF)-α. Die Signalisierung erfolgt zum einen nerval über eine Veränderung der Aktivität des Nervus vagus; Zytokine treten zum anderen auch über Gebiete in Nähe der Hirnventrikel (circumventrikuläre Organe) in das Gehirn ein.
Die Interaktion zwischen Immunsystem und Verhalten wird an drei Bereichen, die nachfolgend erläutert werden, konkretisiert.
2.1.6.1. Proinflammatorische Zytokine haben Effekte auf Erleben und Verhalten
Zytokine (wie IL-1β, IL-6 und TNF-α), deren Spiegel bei Infektionen bzw. Entzündungen erhöht sind, beschleunigen als sog. proinflammatorische Zytokine den Entzündungsvorgang. Als afferente Signale für das ZNS lösen sie Verhaltenseffekte aus, die als „Sickness behavior“ (Krankheitsverhalten) zusammengefasst werden. „Sickness behavior“ ist gekennzeichnet durch Müdigkeit, reduzierten Appetit, verminderte soziale und physische Aktivität, Anstieg von Tiefschlaf und Verminderung von REM-Schlaf, Verschlechterung von Lernen und Gedächtnis, Schmerz, Abschwächung des parasympathischen Tonus, Verflachung von circadianen Rhythmen, Veränderung von Temperaturregulation und des Energiestoffwechsels und Aktivation der HHNA [22] (s. Abbildung 5). Die Symptome weisen dabei z.T. auch Ähnlichkeit zu Symptomen einer Depression auf. Erhöhte Zytokinspiegel werden deshalb als Mitauslöser der Depression bei vulnerablen Individuen angenommen [22]. Es ist naheliegend, dass nicht nur einzelne proinflammatorische Zytokine, sondern auch chronische entzündliche Erkrankungen afferent auf das Gehirn wirken und auf diesem Weg zu den bei diesen Erkrankungen häufig beschriebenen komorbiden depressiven Symptomen beitragen. Auch im Rahmen von Tumorerkrankungen und als Nebenwirkungen der zytostatischen-zytotoxischen Chemotherapie lassen sich sowohl Anstiege proinflammatorischer Zytokine als auch einzelne Symptome des „Sickness behavior“ finden [23].
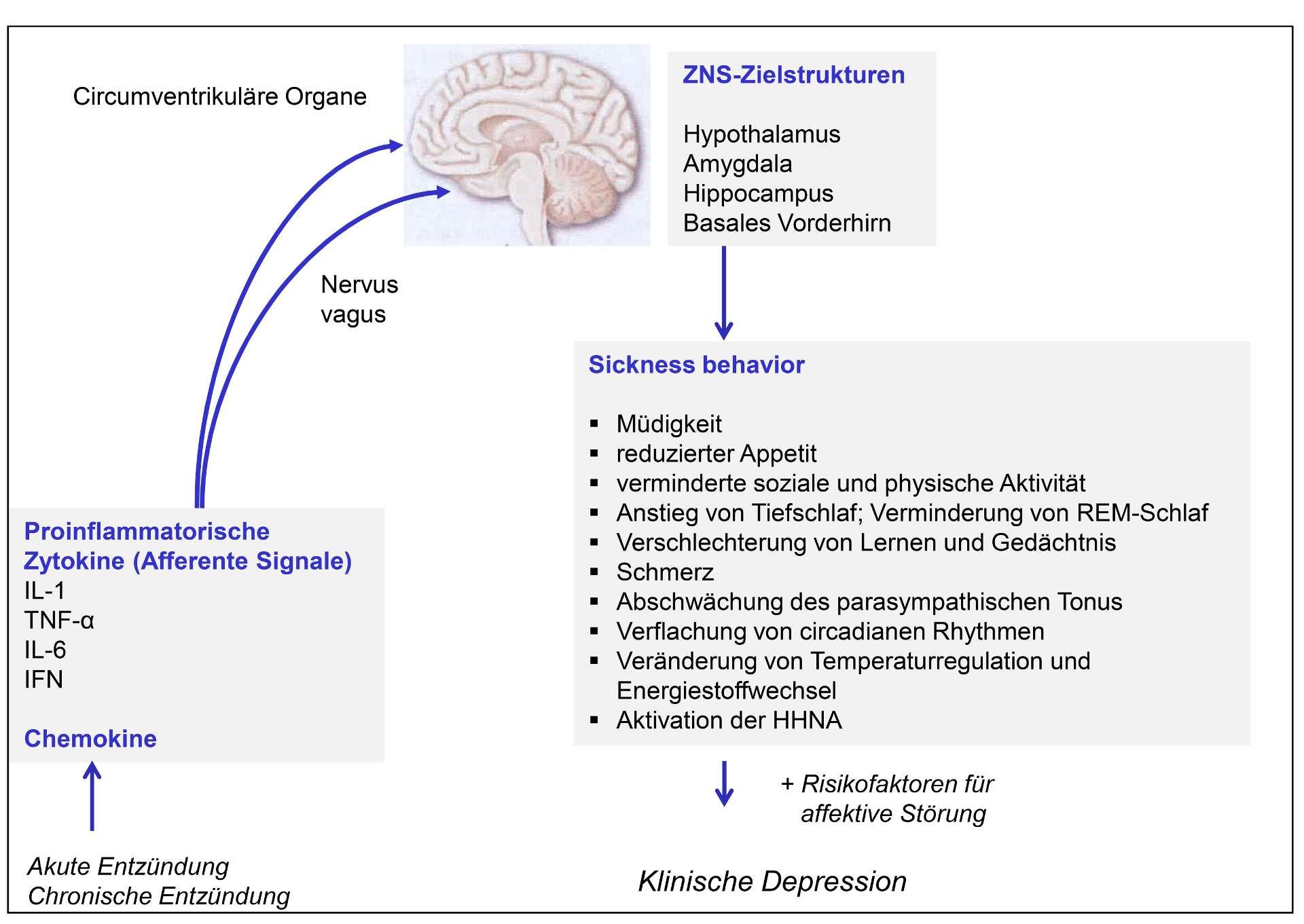
2.1.6.2. Parameter des IS sind sensitiv für akuten und chronischen Stress
Immunkompetente Zellen haben Rezeptoren für Stresshormone, so für Noradrenalin und auch für Cortisol, so dass Stressoren direkt auf Immunparameter einwirken können. Stresshormone können zudem indirekt wirken, indem sie die Freisetzung proinflammatorischer Zytokine verändern. Stressoren können so insgesamt die Anfälligkeit für Infektionen erhöhen, die Stärke von Infektionen steigern und die Dauer der Erkrankungen verlängern, Impfantworten vermindern, latente Viren reaktivieren und die Wundheilung verzögern [24]). Die Wirkung psychischer Variablen wird auch darin deutlich, dass (umgekehrt) kognitiv-behaviorale Therapien immunmodulierend wirksam werden. Bei der Vorhersage der Effekte von Stressoren auf Parameter des Immunsystems ist zu unterscheiden zwischen den Effekten eines akuten vs. chronischen Stressors. Akute Stressoren wirken z.T. fördernd auf Immunparameter. Dagegen ist bei chronischem Stress und längerfristig erhöhten Cortisolspiegeln eine verminderte Freisetzung proinflammatorischer Zytokine und eine Verlängerung der Erkrankungsdauer zu erwarten.
2.1.6.3. Parameter des IS lassen sich klassisch konditionieren
Zelluläre und humorale Parameter des Immunsystems lassen sich auch klassisch konditionieren. Die systematische experimentelle Forschung zur klassischen Konditionierung (s. Kapitel 2.2.3.) von Immunfunktionen begann durch eine Beobachtung von Robert Ader (1974, [25]): In einem typischen Versuchsaufbau zur sog. konditionierten Geschmacksaversion bei Ratten dienten eine Saccharinlösung als CS und eine hohe Dosis (50 mg/kg) des Übelkeit auslösenden Medikaments Cyclophosphamid (CY) als US. Dabei kam es neben einer konditionierten Aversion gegen Saccharin zu einem überraschenden Effekt: Einige der Versuchstiere, die zuvor den CS und CY erhalten hatten, verstarben, wenn sie die Saccharinlösung wieder erhielten, also dem CS re-exponiert waren. Die Mortalitätsrate variierte mit der Menge an Saccharin, die am Konditionierungstag vor der CY-Injektion verabreicht worden war. Diese erhöhte Mortalitätsrate wurde als erster Hinweis auf eine konditionierte Immunsuppression interpretiert, denn CY hat auch immunsuppressive Effekte. Diese Annahme wurde 1975 systematisch von Ader und Cohen [26] in ihrem einschlägigen und sehr gut kontrollierten Tierexperiment verfolgt, wieder mit Saccharin als CS und CY (50 mg/kg) als US: Es ließ sich eine konditionierte Immunsuppression (geringerer Antikörpertiter) nachweisen, wenn die Versuchstiere den zunächst mit dem Immunsuppressivum gekoppelten CS erneut ein oder zweimal nur noch mit einer Placeboinjektion (ohne US) erhielten. Die Arbeiten von Ader und Cohen lösten eine große Zahl von tierexperimentellen Folgestudien aus. Als US werden dabei immunmodulierende Pharmaka, Hormone, Antigene oder Zytokine verwendet, die Effekte auf isolierte Immunparameter haben oder bei Erkrankungen des Immunsystems wirksam werden. Dabei lassen sich – je nach verwendetem US – sowohl stimulierende als auch unterdrückende Effekte auf Immunparameter herbeiführen.
Ein frühes Beispiel im Humanbereich ist der CS-induzierte konditionierte Anstieg der Aktivität der NK-Zellen nach mehrfacher Kopplung eines Geschmacksreizes (CS) mit einer Adrenalininjektion (US) bereits bei Gabe von CS und Placebo [27]. Bei Patienten mit Hausstaubmilbenallergie wurden einzelne der therapeutischen Effekte eines Histamin-1-Rezeptor-Antagonisten (US) konditioniert: Nachdem die Patienten zunächst mehrfach ein neuartig schmeckendes Getränk (CS) mit dem US erhalten hatten, zeigten sie einen therapeutischen Effekt bereits bei CS und Placebo [28]. Ein weiteres Beispiel – wenn auch eine Einzelfallstudie – ist die erfolgreiche Reduktion der Gabe von CY durch zwischenzeitliche Gabe nur des sehr auffälligen CS (Lebertrangeschmack + Rosenduft) plus Placebo nach der dritten Kombination von CS und CY bei einer Patientin, die an einer Autoimmunerkrankung, dem Lupus erythematodes, erkrankt war [29]. Ein klinisch relevantes Beispiel aus dem Animalbereich ist die konditionierte (CS-ausgelöste) Verminderung der Pfotenschwellung bei Ratten, die zunächst die Kopplung zwischen CS und CY zur Behandlung einer experimentell-induzierten rheumatoiden Arthritis erhalten hatten: Es kam auch dann zu einer Abnahme der Schwellung, wenn schließlich nur der CS kombiniert mit einer Placeboinjektion verabreicht wurde [30]. Eindrucksvoll ist auch die Unterstützung der immunsuppressiven Therapie (via CY) bei Hauttransplantaten [31] und bei Herztransplantaten (via Ciclosporin A) [32] bei Ratten: die Überlebensdauer der Transplantate konnte durch zwischenzeitliche CS-Gaben verlängert werden. Ein eindrückliches Beispiel aus dem Humanbereich stellt die Studie von Kirchhof et al. [33] dar: Bei 30 Patienten, die sich schon seit mehreren Jahren (mittlere Dauer bei Frauen ca. 5½ Jahre und bei Männern 6½ Jahre) unter immunsuppressiver Therapie wegen einer Nierentransplantation befanden, erfolgte zunächst über drei Tage (Akquisition) zweimal täglich eine Kopplung zwischen einem CS (salienter Geschmacksreiz) mit dem standardmäßig (zweimal täglich verabreichten) immunsuppressiven Pharmakon (einem Calcineurin Hemmer, nämlich Tacrolimus oder Ciclosporin A). In der sog. Evokationsphase (über zwei Tage) wurde der CS dann zusätzlich zweimal täglich (ohne US) re-exponiert: Insgesamt wurde der CS also nun täglich viermal verabreicht. Im Vergleich zur Standardtherapie führten diese zusätzlichen CS-Expositionen zu einer Abschwächung der T-Zellproliferation. Diese Abschwächung ist ein Indikator einer therapeutisch intendierten, schwächeren Abstoßungsaktivität, die ohne die CS-Exposition zu den entsprechenden Zeitpunkten nicht zu verzeichnen war. Hinzu kam eine tendenzielle Abnahme der Aktivität von Interferon-g und Cortisol [33]. Konditionierungsprotokolle könnten damit pharmakologische Therapien in ihrer Wirkung unterstützen und/oder die Dosisreduktion der eingesetzten Pharmaka begünstigen, was dann von Vorteil ist, wenn zusätzlich zu den Hauptwirkungen unerwünschte Nebenwirkungen auftreten (wie etwa bei der langfristigen Gabe von Immunsuppressiva zur Reduktion von Abstoßungsreaktionen). Klassische Konditionierung von Immunparametern ist damit ein eindrucksvoller Beleg für die Relevanz einer bio-psychologischen Perspektive und für die Interaktion zwischen psychischen und körperlichen Prozessen.
Auch insgesamt wollte dieses Kapitel den Blick dafür schärfen, wie nützlich eine biopsychologische Perspektive sowohl unter grundlagenwissenschaftlichen als auch anwendungsbezogenen Aspekten für die Medizin ist.
References
[1] Herculano-Houzel S. The human brain in numbers: a linearly scaled-up primate brain. Front Hum Neurosci. 2009 Nov 9;3:31. DOI: 10.3389/neuro.09.031.2009[2] Breedlove SM, Watson NV. Behavioral Neuroscience. Sunderland: Sinauer Associates; 2018.
[3] Güntürkün O. Biologische Psychologie. 2., aktualisierte Auflage. Göttingen: Hogrefe; 2019.
[4] von Bartheld CS, Bahney J, Herculano-Houzel S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. J Comp Neurol. 2016 Dec 15;524(18):3865-95. DOI: 10.1002/cne.24040
[5] Schröger, E. Biologische Psychologie. Wiesbaden: VS Verlag für Sozialwissenschaften; 2010.
[6] Wikimedia [Internet]. Visual cortex; 2010 Mar 24 [cited 2018 Oct 21]. Available from: https://commons.wikimedia.org/wiki/File:17cortex.jpg
[7] Carlson NR, Birkett MA. Physiology of behavior. 12th ed. Boston: Pearson; 2017.
[8] Pinel JPJ, Barnes SJ, Pauli P. Biopsychologie. 10., aktualisierte und erweiterte Auflage. Hallbergmoos: Pearson Studium; 2018.
[9] Stockhorst U, Antov MI. Modulation of fear extinction by stress, stress hormones and estradiol: A Review. Front Behav Neurosci. 2016 Jan 26;9:359. DOI: 10.3389/fnbeh.2015.00359
[10] Rudy JW. The neurobiology of learning and memory. 2nd ed. Sunderland: Sinauer Associates; 2014.
[11] iasp-pain.org [Internet]. IASP Terminology. Washington: International Association for the Study of Pain; [cited 2018 Oct 21]. Available from: http://www.iasp-pain.org/Education/Content.aspx?ItemNumber=1698
[12] Hein G, Singer T. I feel how you feel but not always: the empathic brain and its modulation. Curr Opin Neurobiol. 2008 Apr;18(2):153-8. DOI: 10.1016/j.conb.2008.07.012
[13] Eisenberger NI. The pain of social disconnection: examining the shared neural underpinnings of physical and social pain. Nat Rev Neurosci. 2012 May 3;13(6):421-34. DOI: 10.1038/nrn3231
[14] Freberg LA. Discovering biological psychology. 2nd ed. Belmont: Wadsworth; 2010.
[15] Schandry R. Biologische Psychologie. 4., überarbeitete Auflage. Weinheim, Basel: Beltz Verlag; 2016.
[16] Ulrich-Lai YM, Herman JP. Neural regulation of endocrine and autonomic stress responses. Nat Rev Neurosci. 2009 Jun;10(6):397-409. DOI: 10.1038/nrn2647
[17] McEwen BS, Gray JD, Nasca C. 60 years of neuroendocrinology: redefining neuroendocrinology: stress, sex and cognitive and emotional regulation. J Endocrinol. 2015 Aug;226(2):T67-83. DOI: 10.1530/JOE-15-0121
[18] Rodrigues SM, LeDoux JE, Sapolsky RM. The influence of stress hormones on fear circuitry. Annu Rev Neurosci. 2009;32:289-313. DOI: 10.1146/annurev.neuro.051508.135620
[19] Lupien SJ, McEwen BS, Gunnar MR, Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nat Rev Neurosci. 2009 Jun;10(6):434-45. DOI: 10.1038/nrn2639
[20] Trepel M. Neuroanatomie: Struktur und Funktion. 7th ed. München: Urban u. Fischer Verlag/Elsevier; 2017.
[21] Stockhorst U. Konditionierung des Immunsystems. In: Schubert C, editor. Psychoneuroimmunologie und Psychotherapie. 2nd ed. Stuttgart: Schattauer; 2015. p. 201-44.
[22] Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW. From inflammation to sickness and depression: when the immune system subjugates the brain. Nat Rev Neurosci. 2008 Jan;9(1):46-56. DOI: 10.1038/nrn2297
[23] Cleeland CS, Bennett GJ, Dantzer R, Dougherty PM, Dunn AJ, Meyers CA, Miller AH, Payne R, Reuben JM, Wang XS, Lee BN. Are the symptoms of cancer and cancer treatment due to a shared biologic mechanism? A cytokine-immunological model of cancer symptoms. Cancer 2003 Jun 1; 97(11):2919-25. DOI: 10.1002/cncr.11382
[24] Glaser R, Kiecolt-Glaser JK. Stress-induced immune dysfunction: implications for health. Nat Rev Immunol. 2005 Mar;5(3):243-51. DOI: 10.1038/nri1571
[25] Ader R. Letter: Behaviorially conditioned immunosuppression. Psychosom Med. 1974 Mar-Apr;36(2):183-4. DOI: 10.1097/00006842-197403000-00011
[26] Ader R, Cohen N. Behaviorally conditioned immunosuppression. Psychosom Med 1975 Jul-Aug;37(4):333-40. DOI: 10.1097/00006842-197507000-00007
[27] Buske-Kirschbaum A, Kirschbaum C, Stierle H, Lehnert H, Hellhammer D. Conditioned increase of natural killer cell activity (NKCA) in humans. Psychosom Med. 1992 Mar-Apr;54(2):123-32. DOI: 10.1097/00006842-199203000-00001
[28] Goebel MU, Meykadeh N, Kou W, Schedlowski M, Hengge UR. Behavioral conditioning of antihistamine effects in patients with allergic rhinitis. Psychother Psychosom 2008;77(4):227-34. DOI: 10.1159/000126074
[29] Olness K, Ader R. Conditioning as an adjunct in the pharmacotherapy of lupus erythematosus. J Dev Behav Pediatr 1992 Apr;13(2):124-5. DOI: 10.1097/00004703-199204000-00008
[30] Klosterhalfen W, Klosterhalfen S. Pavlovian conditioning of immunosuppression modifies adjuvant arthritis in rats. Behav Neurosci 1983 Aug;97(4):663-6. DOI: 10.1037//0735-7044.97.4.663
[31] Gorczynski RM. Conditioned enhancement of skin allografts in mice. Brain Behav Immun. 1990 Jun;4(2):85-92. DOI: 10.1016/0889-1591(90)90011-E
[32] Grochowicz PM, Schedlowski M, Husband AJ, King MG, Hibberd AD, Bowen KM. Behavioral conditioning prolongs heart allograft survival in rats. Brain Behav Immun 1991 Dec;5(4):349-56. DOI: 10.1016/0889-1591(91)90030-E
[33] Kirchhof J, Petrakova L, Brinkhoff A, Benson S, Schmidt J, Unteroberdörster M, Wilde B, Kaptchuk TJ, Witzke O, Schedlowski M. Learned immunosuppressive placebo responses in renal transplant patients. Proc Natl Acad Sci U S A. 2018 Apr 17;115(16):4223-7. DOI: 10.1073/pnas.1720548115




