Faktoren, die das Ergebnis der Cochlea-Implantat-Versorgung beeinflussen: Besteht ein Zusammenhang zwischen Elektroden-Einführwinkel/Frequenzversatz und Einsilberverstehen?
Emily Gooss 1Uwe Baumann 1
1 Klinik für HNO-Heilkunde, Goethe-Universität Frankfurt, Universitätsklinikum Frankfurt a.M., Deutschland
Zusammenfassung
Hintergrund: Cochlea-Implantate (CI) kommen bei der Wiederherstellung des Hörvermögens von schwerhörigen und tauben Patienten zum Einsatz. Dabei können nicht immer zufriedenstellende Hörergebnisse erreicht werden. Mögliche Einflussfaktoren werden in der Literatur diskutiert, sind jedoch nicht vollständig geklärt. In der vorliegenden Studie wurden anhand eines umfassenden Patientenkollektivs mit fünf verschiedenen Elektrodenträgern der Einfluss des Einführwinkels (angular insertion depth (AID)) sowie die Auswirkungen des Frequenzversatzes (FV) auf das Sprachverstehen (SV) analysiert.
Methodik: N=101 Implantat-Fälle wurden in die Studie eingeschlossen. Es wurden Elektroden-Insertionen der folgenden Implantate untersucht: N=43 Synchrony-Implantate (MED-EL, Innsbruck, Österreich) mit Elektroden FLEX26 und FLEX28 sowie N=58 Nucleus-Implantate (COCHLEAR, Macquarie, Australien) mit Elektroden PRECURVED, STRAIGHT und CONTOUR SLIM. Mittels Otoplan V3.0 (CASCINATION, Bern, Schweiz) wurden postoperative CT-Datensätze zur Bestimmung der Elektrodenpositionen analysiert. Anschließend wurden die tonotope Frequenzzuordnung und der FV ausgewertet. Das postoperative SV wurde für alle Patienten mit dem Freiburger Einsilbertest in Ruhe (EV) nach durchschnittlich 12,2±5,9 Monaten ermittelt.
Ergebnisse: Die mittlere CDL (Cochlear Duct Length) betrug 35,8±3,1 mm (N=101). Die AID-Werte zeigten folgende Ergebnisse: PRECURVED 329,4±39,7° (N=34), STRAIGHT 344,2±34,4° (N=9), CONTOUR SLIM 394,3±37,3° (N=10), FLEX26 496,3±45,0° (N=10) und FLEX28 554,8±49,3° (N=33). Der größte FV zeigte sich unabhängig vom Elektrodentyp an der apikalsten Elektrode. Bei zusammenfassender Auswertung unabhängig vom Hersteller erreichte die Fallgruppe mit AID 400–450° (N=9) mit 80% das beste SV.
Schlussfolgerung: Die Nutzung von Otoplan V3.0 in der klinischen Praxis zur Bestimmung von CDL und AID stellte sich als praktikabel heraus. Es konnte kein signifikanter Zusammenhang zwischen FV und EV festgestellt werden, ebenso wenig wie zwischen AID und EV. Die Ergebnisse legen nahe, dass der FV keinen nennenswerten Einfluss auf das SV hat.
Schlüsselwörter
Cochlea-Implantat, Frequenzversatz, Sprachverstehen, Einführwinkel, Tonotopie
1 Einleitung
Mehrkanal-Cochlea-Implantate (CI) sind seit den 1980er Jahren kommerziell verfügbar und ermöglichen die Wiederherstellung des Hörvermögens von schwerhörigen und tauben Patienten [34]. Aktuelle CI-Systeme bestehen aus einem internen Stimulator mit Elektrodenträger sowie einem externen Audioprozessor, welcher Schallwellen in elektrische Signale umgewandelt an eine Empfangsspule induktiv übertragt. Der Stimulator erzeugt mithilfe des in die Cochlea eingebrachten Elektrodenträgers elektrische Reize zur direkten Stimulation des Hörnervs, wodurch es bei implantierten Patienten zu einem Höreindruck kommt [9]. Trotz weitgehender Erfolge der CI-Rehabilitation können nicht immer zufriedenstellende Hörergebnisse erreicht werden, insbesondere bei ungünstigen akustischen Bedingungen erreichen viele CI-Patienten kein zufriedenstellendes Sprachverstehen (SV) [23]. Der Musikgenuss wird auch nach langer Gewöhnungszeit an das Hören mit CI vielfach als unzureichend beschrieben [4]. Ein wesentlicher Bestandteil der aktuellen Forschung im Bereich CI ist der Zusammenhang von Sprachverständlichkeit, subjektiver Hörqualität und der Insertionstiefe, bzw. dem Insertionswinkel des CI-Elektrodenträgers, resp. des apikalen Abschnitts des Elektrodenträgers. Eine weitere Forschungsfrage untersucht, ob ein geringerer Frequenzversatz (engl. frequency mismatch/frequency shift (FV)) zwischen der Tonotopie der Basilarmembran und der durch Elektrodenlage und Fitting-Einstellung (Frequenzzuordnung) vorgegebenen „Pseudo-Tonotopie“ zu einem besseren SV führt. Die Basilarmembran als zentrale Struktur in der Cochlea trennt den Ductus cochlearis (Scala media) von der Scala tympani, und dient als Basis für das Corti-Organ (engl. organ of corti (OC)), welches die sensorischen Haarzellen enthält. Die Membran zeigt eine graduelle Veränderung ihrer Breite entlang ihrer Länge: Sie ist an der Basis der Cochlea schmal und wird zum Apex hin breiter. Diese anatomische Variation korreliert mit der Funktion der Membran, da tiefe Töne im breiteren apikalen Bereich abgebildet werden und hohe Töne am schmalen basalen Teil der Cochlea. Mit Hilfe einer 1961 von Greenwood [14] entwickelten Formel lässt sich die Ortsfrequenz in Abhängigkeit vom Abstand zum runden Fenster beschreiben. Der Frequenzbereich ist dabei logarithmisch entlang des OC verteilt. Maßgeblich für das Hörergebnis bei CI-Patienten könnte der FV sein, der sich aus der Differenz zwischen der zugewiesenen Mittenfrequenz eines spezifischen Elektrodenfrequenzbands und der tatsächlichen Ortsfrequenz ergibt. Zur genaueren Beschreibung der Zuordnung der Elektrodenposition zum stimulierten Frequenzbereich wird vielfach auf das von Stakhovskaya et al. [31] entwickelte Modell zurückgegriffen. Hierbei wird unterschieden zwischen einer Stimulation nahe des Spiralganglions (SG) oder einer Stimulation nahe der Haarsinneszellen am Cortischen Organ. Aktuelle Studien haben gezeigt, dass die Länge des humanen Ductus Cochlearis (engl. cochlear duct length (CDL)) [5], [11], [12], der Einführwinkel der apikalsten Elektrode (engl. angular insertion depth (AID)) [5], [16], [19] sowie Form und Länge des Elektrodenträgers [19] Einfluss auf den FV nehmen. Canfarotta et al. [5] untersuchten zwei verschieden lange Elektrodenträger des Herstellers MED-EL (Innsbruck, Österreich) und ermittelten eine durchschnittliche AID von 428° für 24 mm lange Elektroden (FLEX24) und 558° für 28 mm lange Elektroden (FLEX28). Das SV wurde nach 1,3 und 6 Monaten gemessen. Nach Ausschluss von stark vom Mittelwert abweichenden Daten („Ausreißern“) war keine signifikante Korrelation zwischen FV und SV festzustellen. Mertens et al. [25] bestimmten für die apikalste Elektrode des FLEX28-Trägers einen FV von 17 Halbtönen im Mittelwert zu höheren Frequenzen. Ebenso wie bei Canfarotta et al. [5] konnte kein Zusammenhang zwischen FV und SV ermittelt werden. Landsberger et al. [19] stellten fest, dass längere Elektrodenträger (FLEX28) im Stimulationsbereich für Frequenzen unter 650 Hz einen geringeren FV zeigten als kürzere Träger (HiFocus 1J und Contour Advance), während sich bei Frequenzen über 650 Hz keine signifikanten Unterschiede im FV zwischen den Elektrodenträgern ergaben. Dutrieux et al. [11] untersuchten 99 Patienten, die mit 106 FLEX28-Elektrodenträgern versorgt waren und beschrieben signifikante Korrelationen zwischen CDL, AID und FV. Der größte FV zeigte sich an der apikalsten Elektrode. In einer Studie von Chakravorti et al. [7] wurde das SV bei MED-EL- und COCHLEAR-Elektrodenträgern untersucht, wobei Einflussfaktoren wie AID, Geschlecht und CI-Nutzungszeit berücksichtigt wurden. Der FV wurde jedoch nicht als möglicher Einflussfaktor einbezogen und die derzeitige Studienlage lässt keinen klaren Zusammenhang zwischen FV und SV erkennen. Die Bedeutung der Parameter CDL und AID auf das Ergebnis der CI-Rehabilitation erscheint nicht vollständig geklärt. Insbesondere fehlt es an umfassenden Vergleichsstudien, welche die Elektrodenträger unterschiedlicher Hersteller systematisch untersuchen, was eine wesentliche Einschränkung im aktuellen Kenntnisstand darstellt. In der vorliegenden retrospektiven Studie wurden deshalb in einem mit fünf verschiedenen Elektrodentypen (Hersteller: MED-EL und COCHLEAR) versorgten Patientenkollektiv die Parameter CDL, Durchmesser, Breite und Höhe der Cochlea, AID, Frequenzzuordnung, FV und das individuelle Einsilberverstehen nach 12 Monaten (EV) erfasst und auf Zusammenhänge untersucht. Das Testintervall 12 Monate nach der Erstanpassung des CI-Prozessors wurde gewählt, da Studien zeigen, dass sich zum Testintervall nach 24 Monaten nur noch geringe Zuwächse des SV ergeben. Somit kann nach 12 Monaten eine weitgehende Adaptation an den individuellen FV angenommen werden [20], [29], [30]. Im Rahmen des Vergleichs der Elektrodenträger wurde erstmals Otoplan auch für Elektroden des Herstellers COCHLEAR verwendet. Das Hauptziel dieser Forschungsarbeit besteht darin, einen potentiellen Zusammenhang zwischen dem AID, dem damit in Verbindung stehenden FV und dem EV festzustellen. Zusätzlich werden die anderen genannten Parameter miteinander korreliert, um mögliche Zusammenhänge zu beschreiben und somit die Qualität der CI-Versorgung weiter zu verbessern.
2 Material und Methoden
2.1 Patientenkohorte
Eine Abfrage der internen CI-Datenbank der Universitäts-HNO-Klinik Frankfurt ergab im Zeitraum von 2017 bis 2021 N=236 im Erwachsenenalter mit CI versorgte Ohren. Durch Anwendung der Einschlusskriterien „Deutsch als Muttersprache“ und vorhandene post-operative CT-Bilddaten verblieben N=229. Fälle ohne FBE-Testergebnisse (N=6) sowie Fälle mit Hörnervdefekt (N=2) wurden ausgeschlossen. Nach dem Ausschluss von nicht auswertbaren CT-Datensätzen (N=8) und Versorgung mit elektrisch-akustischer oder hybrider Stimulation (N=4) verblieben N=190 CI-versorgte Ohren. Aufgrund zeitlicher Rahmenbedingungen wurde eine Stichprobe von N=101 Fällen ausgewählt. Die Auswahl erfolgte randomisiert durch einen nicht an der Studie beteiligten Mitarbeiter der audiologischen Abteilung der Universitätsklinik Frankfurt. Die gewählte Stichprobengröße wurde näherungsweise als hinreichend erachtet, um eine repräsentative Analyse zu ermöglichen. Es verblieben somit N=101 CI-versorgte Ohren (N=55 weiblich und N=46 männlich; Altersdurchschnitt 57±15 Jahre). Die Ursache der Hörminderung blieb in N=67 Fällen unbekannt. Als bekannte Ursachen zeigten sich ein idiopathischer Hörsturz (N=13), gefolgt von chronisch progredienter Verschlechterung des Hörvermögens (N=6) und kongenitalen Gründen (N=5). Mit jeweils N=3 sind Infektionen und Meningitis ursächlich. Otosklerose, genetische Gründe, Mukopolysaccharidose Typ II und Morbus Menière sind mit jeweils N=1 in der Kohorte vertreten. Die Auswahl der Elektroden wurde nur bei speziellen anatomischen oder pathologischen Voraussetzungen vom Operateur vorgenommen. In allen anderen Fällen lag diese Entscheidung in den Händen des Patienten, der diese im Rahmen eines ausführlichen Beratungsgesprächs getroffen hatte. Die untersuchten Elektrodentyp-Gruppen waren sich hinsichtlich der Faktoren Alter, Geschlecht und Ätiologie homogen.
2.2 Implantate und Elektrodenträger
Insgesamt wurden N=43 Synchrony-Implantate mit den Elektrodenträgern FLEX26, FLEX28 (MED-EL, Innsbruck, Österreich) sowie N=58 Nucleus-Implantate mit den Elektrodenträgern PRECURVED (CI512, CI612), STRAIGHT (CI522, CI622) oder CONTOUR SLIM (CI532, CI632) des Herstellers COCHLEAR (Macquarie, Australien) eingesetzt (Tabelle 1 [Tab. 1]). Deaktivierte Elektrodenkontakte und unvollständig inserierte Elektrodenträger sind in Tabelle 1 [Tab. 1] nach Elektrodentyp aufgelistet. Elektrodenträger mit vollständiger Insertion wiesen deaktivierte Elektroden wie folgt auf: 5x1, 6x2, 4x3, 1x4 und 1x6 deaktivierte Elektroden. Bei unvollständig inserierten Elektrodenträgern wurden folgende Varianten beobachtet: 2x2, 2x3 und 1x6 deaktivierte Elektroden. Fälle mit unvollständig inserierten Elektrodenträgern (STRAIGHT N=4, PRECURVED N=1) wurden bei den Auswertungen zu AID und FV ausgenommen, um eine Verzerrung der Ergebnisse zu vermeiden.
Tabelle 1: Verwendete Elektroden mit Häufigkeiten, Elektrodenlänge in mm, Anzahl der Elektrodenträger mit unvollständiger Insertion und Anzahl der Elektrodenträger mit deaktivierten Elektrodenkontakten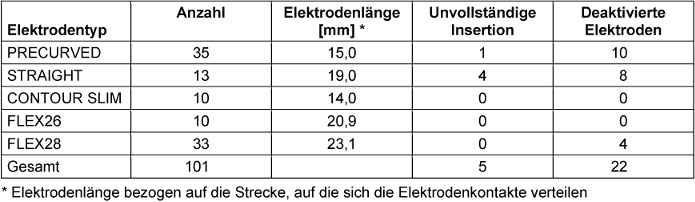
2.3 CI-Prozessoren und CI-Rehabilitation
Bei MED-EL Nutzern wurden folgende Sprachprozessoren verwendet: SONNET, SONNET 2, SONNET EAS, RONDO 2, RONDO 3. Bei Nutzern von COCHLEAR-Implantaten wurden CP1000, CP950, CP920, CP910, CP810 und KANSO 2 Sprachprozessoren genutzt. Nach der CI-Versorgung wurde allen Patienten eine systematische Rehabilitation verordnet, entweder im Rahmen eines drei- bis fünfwöchigen stationären Aufenthalts in einer spezialisierten Rehabilitationseinrichtung oder durch das Absolvieren von 20 ambulanten Rehabilitationseinheiten, die in der Regel innerhalb von 12 Monaten durchgeführt wurden. Die Patienten erhielten nach 3, 6, und 12 Monaten und im Anschluss jährlich Termine zur medizinischen und audiologischen Kontrolle des CI-Systems.
2.4 Analyse der Bilddaten
Die CT-Datensätze wurden aus dem PACS (Picture Archiving and Communication System, GE Healthcare, Frankfurt) des Universitätsklinikums Frankfurt extrahiert und anschließend in das Bilddaten-Rekonstruktionsprogramm Otoplan V3.0 importiert (CAScination AG, Bern, Schweiz). Zur Bestimmung der CDL wurden die Schnittbilddaten in allen drei Raumebenen ausgerichtet, um dessen Grenzen sowie die Position des runden Fensters festzulegen. Für die Berechnung kam die elliptisch-zirkuläre Approximationsmethode (engl.: eliptic-circular approximation (ECA)) zum Einsatz (Anhang 1 [Anh. 1], Appendix 1). Die Methode nutzte folgende Gleichung:
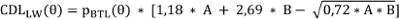
mit:
CDLLW(θ): Ort an der der lateralen Wand (LW) der Cochlea in Abhängigkeit von θ
A: Durchmesser der Cochlea, gemessen linear von der Mitte des runden Fensters bis zum äußersten Punkt der gegenüberliegenden Seitenwand (nach Escudé et al. [12])
B: Breite der Cochlea, gemessen senkrecht zu A, durch die Modiolus-Achse
pBTL: Konstanten, die für jeden Winkel θ entlang der Cochlea festgelegt wurden
2.5 Bestimmung des Einführwinkels
Die Detektion der Position der Elektroden erfolgte im ersten Ansatz mittels Otoplan V3.0, welche im Anschluss überprüft, und bei Bedarf manuell korrigiert wurden. Zur Bestimmung der AID der einzelnen Elektroden musste die Cochlea gemäß der Beschreibung im vorherigen Abschnitt ausgerichtet werden. Zusätzlich wurde ein Null-Referenzwinkel bestimmt, eine Bezugslinie, die sich vom Mittelpunkt des runden Fensters bis zum Modiolus, dem Zentrum der Cochlea, erstreckt. Die Bestimmung der angularen Position der Elektroden wurde mit dieser Bezugslinie als Referenz im Anschluss aus Otoplan ausgelesen.
2.6 Bestimmung der Elektrodenposition und tonotope Zuordnung
Die tonotope Zuordnung der apikalsten Elektrodenposition (Elektrode 22 bei Nucleus-Implantaten, Elektrode 1 bei Synchrony-Implantaten) wurde für zwei Bezugsebenen innerhalb der Cochlea vorgenommen: Ebene des Corti-Organs (OC) und Ebene des Spiralganglions (SG). Die entsprechenden Angaben zur tonotopen Zuordnung wurden aus der tabellarischen Auflistung in Otoplan übernommen.
2.7 Ermittlung der Frequenz-Zuordnung
Für die meisten Patienten der Kohorte lag eine Standard-Frequenz-Zuordnung vor. Die individuelle Frequenz-Zuteilung wurde bei Synchrony-Implantaten durch Betrachtung der zum Zeitpunkt des Sprachtests genutzten Einstellung des CI-Prozessors mithilfe der klinischen Software des Herstellers ermittelt (MAESTRO 9.0, MED-EL, Innsbruck). Der Übertragungs-Frequenzbereich erstreckt sich bei der Standard-Frequenz-Zuordnung von 70 bis 8.500 Hz, welcher sich logarithmisch auf die aktiven 12 Elektroden verteilt [10]. Für die apikalste Elektrode liegt dann eine Mittenfrequenzen von fm=120 Hz vor. Bei Nucleus-Implantaten erstreckte sich der Standard-Übertragungs-Frequenzbereich von 170 bis 7.200 Hz. Die Standard-Mittenfrequenz liegt an der apikalsten Elektrode bei 242,6 Hz. Bei einigen Patienten wurde eine vom Standard abweichende Frequenz-Zuteilung vorgenommen. Hierbei wurde die Mittenfrequenz der apikalsten Elektrode zu höheren Frequenzen verschoben. Dies betraf bevorzugt FLEX26 und STRAIGHT Elektrodenträger. Unabhängig vom Implantat-Typ wurden extracochleär gelegene Elektrodenkontakte deaktiviert und die Frequenzfilter entsprechend auf die verbliebenen Elektrodenkontakte umverteilt.
2.8 Bestimmung des Frequenzversatzes
Der FV berechnet sich aus der Differenz der über die Einstellung des CI-Prozessors festgelegten Mittenfrequenz des einer Elektrode zugeordneten Frequenzbands und der durch die Lage der Elektrode bestimmten tonotopen Zuordnung. Diese Diskrepanz entsteht, wenn die Zuordnung der Frequenzbänder im Sprachprozessor nicht mit der natürlichen tonotopen Organisation der Cochlea übereinstimmt.
2.9 Postoperatives Sprachverstehen
Die Ergebnisse des Freiburger Einsilbertests in Ruhe wurden für alle Probanden bei einem Freifeld-Präsentationspegel von 65 dB SPL ermittelt. Es wurden überwiegend Daten der Kontrolle 12 Monate nach Erstanpassung für die Auswertung herangezogen. Da in Einzelfällen dieser Kontrolltermin verschoben werden musste (z.B. nach verzögertem Beginn der Rehabilitation), lag der durchschnittliche Zeitpunkt dieser Kontrolle bei 12,2±5,9 Monaten. Alle audiometrischen Messungen wurden in schallisolierten Räumen von IAC Acoustics (Winchester, UK) durchgeführt, die mit klinischen Audiometern Equinox 2.0 (Interacoustics, Middelfart, Dänemark) und Lautsprechern CD 220.3 (Canton Elektronik GmbH, Weilrod) für die Freifeldpräsentation ausgestattet waren. Die Kalibrierung wurde regelmäßig gemäß Herstellerangaben durch einen Kalibrierdienst überprüft. Die Patienten nutzten bei der sprachaudiometrischen Überprüfung die gewohnte Alltagseinstellung ihrer CI-Prozessoren.
2.10 Statistik
Die statistische Analyse wurde mit SPSS Statistics 28.0 (IBM Corporation, Endicott, NY, U.S.A.) durchgeführt. Zur Darstellung der Daten wurden deskriptive Statistiken und Boxplots verwendet. Die Ergebnisse werden als Median ± Standardabweichung (SD) angegeben. Für Daten, die nicht der Normalverteilung unterliegen, wurde die Spearman-Rangkorrelation angewendet. Paarweise Vergleiche bei unabhängigen Stichproben wurden mit dem Kruskal-Wallis-Test berechnet. Ein p-Wert von p<0,05 wurde als statistisch signifikant angesehen.
3 Ergebnisse
3.1 Cochlea-Parameter
Die ECA-Methode ergab im Mittelwert eine CDL von 35,8 mm (Md=36,0 mm, N=101, SD=3,1) mit einer Spanne von 25,8 bis 46,2 mm. Der mittlere Durchmesser der Cochlea betrug A=9,2 mm (SD=0,7), die Breite B=6,8 mm (SD=0,7) und die Höhe H=3,8 mm (SD=0,5). Eine Korrelation zwischen CDL und der Anzahl deaktivierter Elektroden zeigte sich nicht signifikant (r=0,082, p=0,414).
3.2 Einführwinkel (AID)
Die Auflistung der AID für die apikalste Elektrode, unterteilt nach Elektrodentyp, ist in Tabelle 2 [Tab. 2] dargestellt. Es zeigte sich ein signifikanter Zusammenhand zwischen CDL und AID der apikalsten Elektrode für FLEX28-Nutzer (r=–0,396, p=0,023) und PRECURVED-Elektroden (r=–0,481, p=0,003). FLEX26 (r=–0,576, p=0,082), STRAIGHT (r=–0,418, p=0,156) und CONTOUR SLIM-Elektroden (r=–0,539, p=0,108) zeigten keinen signifikanten Zusammenhang.
Tabelle 2: Auflistung der Einführwinkel (in Winkelgrad, °) für die apikalste Elektrode, unterteilt nach Elektrodentyp; unvollständig inserierte Elektroden (N=5) ausgenommen; Standardabweichung (SD)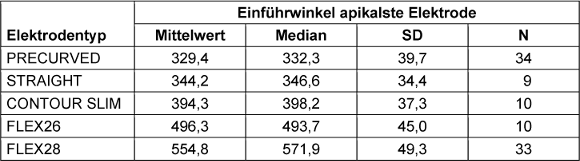
3.3 Tonotope Zuordnung
Die tonotope Zuordnung abhängig vom Elektrodeninsertionswinkel erfolgte sowohl auf der Ebene des Spiralganglions (SG) als auch auf der Ebene des Corti-Organs (OC) (Abbildung 1 [Abb. 1]).
Abbildung 1: Boxplot, tonotope Zuordnung (in Hz), bestimmt aus dem Elektrodeninsertionswinkel der apikalsten Elektrode für verschiedene Elektrodenträger. SG-Freq (blau): Spiralganglion Ebene, OC-Freq (rot): Organ of Corti Ebene. N-Werte siehe Tabelle 1, unvollständig inserierte Elektroden (N=5) ausgenommen, (Zahlenwerte siehe Tab. 4 in Anhang 1, Appendix 2).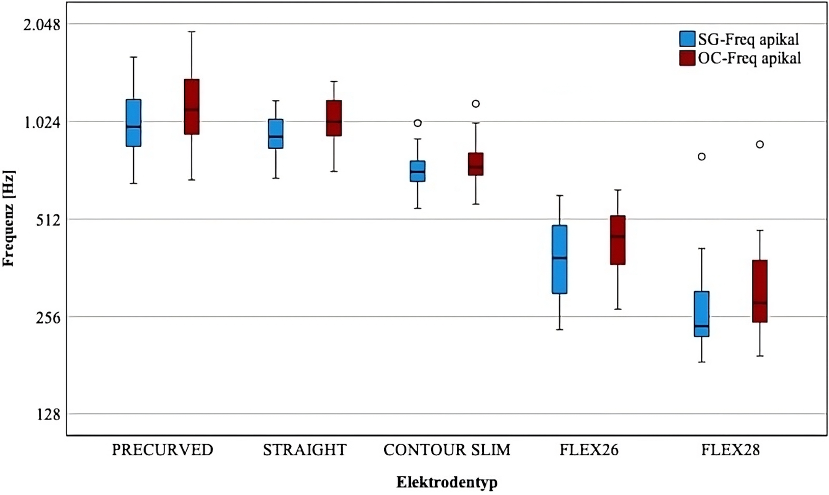
3.4 Frequenzversatz
Der ermittelte FV in Halbtonschritten ist in Tabelle 3 [Tab. 3] für die untersuchten Elektroden aufgeführt. Der FV ist für jeden Elektrodentyp am OC größer als am SG.
Tabelle 3: Frequenzversatz gemessen in Halbtonschritten für die apikalste Elektrode, differenziert nach SG, OC und Elektrodentyp, FV: Frequenzversatz. Unvollständig inserierte Elektroden (N=5) ausgenommen.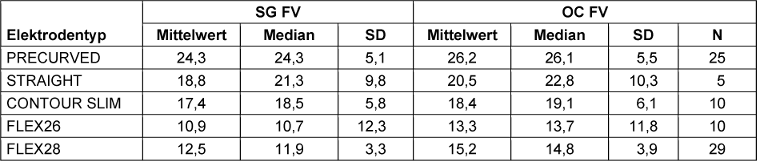
Ein Kruskal-Wallis-Test zeigt, dass der FV in Halbtonschritten (d.h. Frequenzverhältnis zwei hoch ein Zwölftel pro Halbtonschritt) durch die Art des Elektrodenträgers beeinflusst wird (SG-FV H=64,060, p<0,001, df=4; OC-FV H=63,991, p<0,001 df=4). Anschließend durchgeführte Post-hoc-Tests (Dunn-Bonferroni-Tests) zeigen, dass sich die Elektrodenträger FLEX28 und STRAIGHT (H=29,470, SE=10,367, p=0,045), FLEX28 und PRECURVED (H=51,348, SE=6,787, p<0,001) und FLEX26- und PRECURVED-Elektroden (H=48,795, SE=9,951, p<0,001) signifikant am SG der apikalsten Elektrode unterscheiden. Die Ergebnisse der Varianzanalyse sind in Tab. 5 in Anhang 1 [Anh. 1], Appendix 2, dargestellt. Die restlichen Vergleiche zeigten keine Signifikanz.
3.5 Einsilberverstehen
Zwischen den verschiedenen Elektrodenträgertypen zeigte sich in Bezug auf das Einsilberverstehen kein signifikanter Unterschied (H=6,609, p=0,158, df=4). Für eine Elektrodentyp-unabhängige Betrachtung wurde der AID der apikalsten Elektrode in 50°-Schritte unterteilt und die Ergebnisse des Freiburger-Einsilbertests mit den entsprechenden AID-Kategorien aufgeschlüsselt (Abbildung 2 [Abb. 2]).
Abbildung 2: Boxplot, Übersicht über gruppierte Einführwinkel der apikalsten Elektrode, Hersteller-unabhängig, Ergebnisse des Freiburger Einsilbertests (%), hier entsprechend der Werte aus Tab. 6 in Anhang 1, Appendix 2, unvollständig inserierte Elektroden (N=5) ausgenommen.
3.6 Korrelationen
Die Ergebnisse des Freiburger-Einsilbertests wurden mit dem FV (bezogen auf OC- und SG-Ebene) der apikalsten Elektrode korreliert. Die Ergebnisse der Rangkorrelation nach Spearman zeigten sich nicht signifikant (SG-FV r=0,017, p=0,867; OC-FV r=0,018, p=0,859). Die Korrelation zwischen den Ergebnissen des Freiburger-Einsilbertests und dem Alter der Patienten bei der CI-Versorgung (r=–0,022, p=0,826), zeigte ebenso wie die zwischen EV und AID der apikalsten Elektrode (r=–0,048, p=0,645) keine Signifikanz. Ein Vergleich zwischen Patienten mit und ohne deaktivierte Elektrodenkontakte zeigte sich bezüglich EV nicht signifikant (p=0,351, df=1). Die vorliegende Arbeit hatte zum Ziel, den Einfluss des AID der Elektrodenspitze sowie den Einfluss des FV bei fünf verschiedenen Elektrodenträgern auf das SV an einem großen Patientenkollektiv zu untersuchen. Die Ergebnisse der statistischen Auswertungen legen nahe, dass der FV möglicherweise nicht so entscheidend für das SV von einsilbigen Prüfwörtern ist wie bisher angenommen.
4 Diskussion
4.1 Cochlea-Ductus-Länge (CDL)
Die Bestimmung des Parameters CDL erfolgte mittels des Systems Otoplan Version 3.0 und ergab einen Gesamtmittelwert von 35,8 mm (N=101, SD=3,1). Die erzielten Ergebnisse zeigen eine gute Übereinstimmung mit den Resultaten einer Meta-Analyse von Koch et al. [17], welche einen vergleichbaren Wert von 35,04 mm (29,7–38,9 mm Spanne) ermittelten. In einer Studie von Dutrieux et al. [11] wurden ausschließlich Patienten mit einer FLEX28-Elektrodenträger-Versorgung untersucht (N=106). Die Ermittlung der CDL erfolgte mittels OTOPLAN Version 1.2 und der Alexiades-Formel [1]. Dabei wurde eine CDL von 34,5 mm ermittelt. Die Resultate der hier präsentierten Studie zeigen eine weitgehende Übereinstimmung mit jenen aus der Literatur. Die Analyse von CT-Datensätzen unter Verwendung der in der Software Otoplan implementierten Rekonstruktionsalgorithmen erwies sich somit als geeignete Methode zur Bestimmung der CDL. In Anbetracht der signifikanten Variabilität der CDL erscheint die Auswahl anhand einer zuvor bestimmten individuellen CDL für die Elektrodenträger-Bauform grundsätzlich sinnvoll.
4.2 Beeinflusst eine unvollständige Insertion das Sprachverstehen?
Basal gelegene Elektroden können entweder aufgrund unvollständiger Insertion oder im Rahmen der postoperativen Anpassung des CI-Prozessors aufgrund von unangenehmen Hörempfindungen deaktiviert werden. Es ist zu erwarten, dass eine geringere Größe der Cochlea eine höhere Wahrscheinlichkeit für eine unvollständige Elektrodeninsertion bedingt. Bei der anteilmäßigen Auswertung zeigten sich bei Patienten mit der eher kürzeren STRAIGHT-Elektrode häufiger deaktivierte und unvollständig inserierte Elektroden (Tabelle 1 [Tab. 1]). Als Ursache hierfür könnte das Design dieses Elektrodenträgers mit relativ naher Lage der basalen Elektroden zum runden Fenster diskutiert werden. Heutink et al. [15] untersuchten die Auswirkung von unvollständig inserierten Elektroden auf das SV. Dabei zeigten sich bei 13 Patienten mit unvollständig inserierten PRECURVED- oder STRAIGHT-Elektrodenträgern der Studie keine statistisch signifikanten Unterschiede des SV im Vergleich zu vollständig inserierten Elektroden. Diese Beobachtungen konnten mit den in der hier vorliegenden Studie ermittelten Daten bestätigt werden. Eine unvollständige CI-Implantation sowie die Deaktivierung der Elektroden wiesen in der hier untersuchten Kohorte keine signifikante Auswirkung auf das SV auf und bestätigen die Beobachtungen von Heutink et al. [15].
4.3 Einführwinkel (AID)
Die variierenden AID der einzelnen Elektrodentypen resultieren aus ihren unterschiedlichen Längen und Konturformen. Darüber hinaus sind die individuellen anatomischen Merkmale der Cochlea und die Verteilung der Elektroden entlang der Elektrodenträger zu berücksichtigen. Die PRECURVED-Elektroden (CI512, CI612) weisen eine vorgegebene Krümmung auf. Der AID der apikalsten Elektrode erreicht 332,3° (N=34, SD=39,7) und zeigt damit im Gruppenvergleich den niedrigsten Wert. In einer Studie von Peters et al. [27] wurde ein AID von 307,3° für CI512-Elektrodenträger bei einer Patientenzahl von N=6 festgestellt. In einer Studie von Canfarotta et al. [6] ergaben N=7 PRECURVED-Elektroden einen AID von 364°. Die STRAIGHT-Elektrode (CI522, CI622) resultiert aufgrund der Nähe zur lateralen Wand in einem AID [22] von 346,6° (N=9, SD=34,4). In einer systematischen Literaturübersicht ermittelten Breitsprecher et al. [3] einen etwas größeren AID von 370° für STRAIGHT-Elektroden. Die CONTOUR SLIM-Elektrode ist mit 14 mm (Tabelle 1 [Tab. 1]) die kürzeste unter den untersuchten Elektrodentypen. Das Design dieses Elektrodenträgers ermöglicht durch die enge Anschmiegung an den Modiolus bei gleichzeitig geringer Länge einen großen AID, wodurch ein Wert von 398,2° (N=10, SD=37,3) erzielt wird. Diese Ergebnisse sind in guter Übereinstimmung mit dem von McJunkin et al. [24] ermittelten durchschnittlichen AID von 406° (Implantatmodell CI532). Die FLEX26-Elektrode zeigte in einer Untersuchung von Ketterer et al. [16] einen durchschnittlichen AID von 517° (N=15), der zwar etwas über dem in dieser Studie ermittelten Wert lag (AID=493,7°, N=10, SD=45,0), jedoch aufgrund der großen Streuung der Daten durchaus in den Rahmen der Ergebnisse fällt. Die FLEX28-Elektrode ist die längste unter den hier untersuchten Elektrodenträgern. Der mittlere AID für diese Elektrode lag mit 571,9° (N=33, SD=49,3) etwas über dem von Canfarotta et al. [5] berichteten Wert (558°). Die in früheren Studien von Canfarotta et al. [5], [6], Ketterer et al. [16] und Venail et al. [32] getroffenen Aussagen, wonach längere FLEX28-Elektrodenträger im Vergleich zu FLEX26-Elektroden einen größeren AID aufweisen, konnten durch unsere Untersuchungsergebnisse bestätigt werden. Die von Heutink et al. [15] getroffene Feststellung, dass PRECURVED-Elektroden tiefer in der Cochlea liegen als STRAIGHT-Elektroden, konnte hier nicht bestätigt werden. Ursache hierfür könnte das relativ kleine Patientenkollektiv mit STRAIGHT-Elektroden-Versorgung (N=9) sein (PRECURVED-Elektroden N=34). Der Einsatz von Otoplan Version 3.0 erwies sich somit auch für Elektroden des Herstellers COCHLEAR als ein geeignetes Werkzeug, um den Parameter AID präzise zu bestimmen.
4.4 Zusammenhang zwischen CDL und AID
Der Zusammenhang zwischen CDL und AID an der apikalsten Elektrode zeigte sich bei FLEX28- und PRECURVED-Elektroden signifikant. Bei FLEX26, STRAIGHT- und CONTOUR SLIM-Elektroden konnte kein signifikanter Zusammenhang nachgewiesen werden. Canfarotta et al. [5] untersuchten den Zusammenhang zwischen CDL und AID bei FLEX-Elektrodenträgern. Dabei zeigte sich ein signifikanter Zusammenhang bei vollständig inserierten Elektrodenträgern (p<0,05). Dutrieux et al. [11] konnte bei FLEX28-Elektroden (N=106) ebenfalls einen signifikanten Zusammenhang zwischen CDL und AID feststellen. Die stärkste Korrelation fand die Autorin an der apikalsten Elektrode (p<0,0001). Die Ergebnisse früherer Studien konnten somit mit den hier vorgestellten Daten zumindest für FLEX-Elektrodenträger bestätigt werden. Das negative Vorzeichen der Korrelation bestätigt, dass größere CDL-Werte wie erwartet eine geringere AID zur Folge haben. Soll eine bestimmte Einführtiefe – gemessen am AID – erreicht werden, ist eine Bestimmung der individuellen CDL empfehlenswert. Allerdings können nach Pietsch et al. [28] sowohl an der lateralen als auch bevorzugt an der modiolaren Wand anatomisch bedingte Variationen der Cochlea auftreten, die dem Erreichen eines den präoperativen Planungen entsprechenden Insertionswinkels entgegenwirken. Auch Breitsprecher et al. [2] stellten bei präoperativen Planungen mittels CT Abweichungen des AID von 5% fest, was möglicherweise die Verwendung eines Korrekturfaktors erfordert.
4.5 Frequenzversatz
Im Rahmen der vorliegenden Studie wurde für die untersuchten Elektrodenträger ein durchschnittlicher FV in Halbtonschritten ermittelt. Bei größerer AID wird der FV geringer. Die Korrelationsanalyse zwischen AID und FV zeigte einen stark negativen, hochsignifikanten Zusammenhang (r=–0,905, p<0,001). Dies erlaubt den Rückschluss, dass der FV bei größerer AID geringer wird. Die mittlere Orts-Frequenz für die apikalste FLEX28-Elektrode liegt etwa 12 Halbtöne über der SG-Frequenz. Diese Abweichungen liegt bei der FLEX26-Elektrode bei etwa 11 Halbtönen, während die CONTUR SLIM-Elektrode Abweichungen von 18 Halbtönen aufwies. Die Gruppe der STRAIGHT-Elektroden zeigte einen FV von 21 Halbtönen. Dieser sank um etwa 3 Halbtöne, wenn alle Fälle in der Auswertung berücksichtigt wurden. Die PRECURVED-Elektrode zeigt mit 24 Halbtönen den größten FV. Neumayer et al. [26] beobachteten bei FLEX28-Elektroden einen ähnlichen apikalsten FV, während Mertens et al. [25] sogar einen FV von über 17 Halbtönen beschrieben. In Übereinstimmung mit dem in dieser Studie ermittelten Wert berichteten Canfarotta et al. [5] für FLEX28-Elektroden an der apikalsten Elektrode einen ähnlichen FV. Dutrieux et al. [11] beschrieben für FLEX28-Elektroden, bezogen auf die Greenwood Map [13], ebenfalls einen FV von 10–16 Halbtönen an der apikalsten Elektrode. Landsberger et al. [19] ermittelten für kürzere Elektrodenträger (HiFocus 1J und Contour Advance) apikal (unterhalb 650 Hz) einen größeren FV als für längere Elektrodenträger (FLEX28), während sich weiter basalwärts (oberhalb 650 Hz) keine signifikanten Unterschiede im FV zwischen den Elektrodenträgern ergaben. Dieser größere FV für kürzere Elektrodenträger entspricht den Ergebnissen der PRECURVED- und CONTOUR SLIM-Elektroden in dieser Studie. Die Ergebnisse des FV an den apikalsten Elektroden bestätigen die Ergebnisse früherer Studien und lassen den Schluss zu, dass die Länge des Elektrodenträgers den FV beeinflusst und kürzere Elektroden erwartungsgemäß zu einem höheren FV der apikalsten Elektrode führen. Etwas unerwartet zeigte sich eine geringere Abweichung im FV bei der kürzeren FLEX26-Elektrode im Vergleich zu der FLEX28-Elektrode. Dies ist durch Anhebung der tiefsten Übertragungsfrequenz bei Patienten mit residuellen Tieftongehör erklärbar. Bei 6/10 Patienten wurde eine von der Default-Frequenz abweichende Einstellung zu höheren Frequenzen gewählt. Es konnte ein signifikanter Unterschied im FV zwischen den FLEX28- und CONTOUR SLIM-Elektroden nachgewiesen werden. Nach Durchführung der Bonferroni-Korrektur für Mehrfachvergleiche zeigt sich ein Trend zur Signifikanz (p=0,055, siehe Tab. 5 in Anhang 1 [Anh. 1], Appendix 2). Es sei darauf hingewiesen, dass das Patientenkollektiv für die CONTOUR SLIM-Elektroden (N=10) kleiner ist als das der FLEX28-Elektroden (N=33).
4.6 Zusammenhang zwischen Sprachverstehen und Frequenzversatz
Das Rehabilitationsergebnis der Patienten der vorliegenden Studie wurde mittels der Ergebnisse des Freiburger Einsilbertests nach 12 (±6) Monaten ermittelt. Die vorliegenden Daten wiesen keinen signifikanten Zusammenhang zwischen FV und EV nach. Es ist denkbar, dass die Adaptation des jeweiligen Probanden an den individuellen FV nach 12 Monaten zum Ausbleiben eines signifikanten Einflusses auf das EV führt. Canfarotta et al. [5], [6] untersuchten den Einfluss des FV bei 1.500 Hz auf das CVC Testergebnis bei FLEXSOFT, FLEX28 und FLEX24 CI-Trägern, die eine rein elektrische Stimulation nutzen (N=48). Ein geringerer FV sagte bessere CNC-Ergebnisse nach einem Monat (r=–0,367, p=0,010), drei Monaten (r=–0,334, p=0,021) und sechs Monaten (r=–0,401, p=0,005) voraus. Videhult et al. [33] verglichen das mit CONTOUR SLIM- und PRECURVED-Elektroden erreichte SV und konnten 1 Jahr postoperativ keine signifikanten Unterschiede im SV zwischen den beiden Gruppen feststellen. In einer systematischen Literaturübersicht von Breitsprecher et al. [3] konnte bei sieben Studien kein signifikanter Zusammenhang zwischen AID und Sprachwahrnehmung festgestellt werden. In fünfzehn Studien konnte hingegen eine signifikante Korrelation oder ein positiver Effekt nachgewiesen werden. Eine Studie zeigte zudem einen signifikant negativen Zusammenhang. Chakravorti et al. [7] führten Untersuchungen zu Modellen von MED-EL (N=50) sowie zu Modellen von COCHLEAR (N=120) durch, wobei sich kein Zusammenhang zwischen dem Parameter AID und dem SV (CNC Words und BKB-SIN) feststellen ließ. Bisher wurden überwiegend längere Elektrodenträger in Bezug auf den Zusammenhang FV und EV untersucht. Lediglich eine Arbeit mit kürzeren Elektrodenträgern (Advanced Bionics) liegt vor [18]. Diese zeigte einen gegenteiligen Effekt, nämlich dass eine Verringerung des FV zu einer Verschlechterung des SV führt. Das Ergebnis des SV nach 12 Monaten zeigt in der hier untersuchten Patientenkohorte in Übereinstimmung mit zahlreichen publizierten Studien keinen statistisch gesicherten Zusammenhang mit dem FV. Schlussfolgernd daraus ergibt sich, dass auch der Parameter AID nicht als entscheidendes Kriterium für das SV betrachtet werden kann.
4.7 Limitationen der Studie
Es ist anzunehmen, dass für die apikalste Elektrode bei vorgeformten Elektrodenträgern eher die „SG“ Lage und bei geraden Elektroden die „OC“ Lage vorherrscht. Eine definierte Lagebestimmung konnte aufgrund der eingeschränkten Auflösung des CT-Scans (Schichtdicke 0,4–1 mm) nicht erfolgen, weshalb beide Angaben aufgeführt werden. Die Beurteilung von Skalenwechseln ist auch wegen des Aufhärtungsartefakts der Platin-Elektroden in der Bildgebung nur sehr eingeschränkt und mit großer Unsicherheit belegt und wurde daher nicht durchgeführt. Die geringen Fallzahlen der FLEX26- und CONTOUR SLIM-Elektrodenträger könnten die Aussagekraft der Ergebnisse beeinträchtigen. Die unterschiedlichen Abstände zwischen den einzelnen Elektroden bei verschiedenen Elektrodenträgern bergen das Potenzial für Ungenauigkeiten bei der Bestimmung des FV durch Otoplan. Hier könnte bei SSD-Patienten die Durchführung eines individuellen Tonhöhenvergleichs mit dem akustisch hörenden Gegenohr eingesetzt werden, um eine genauere Zuordnung der Filtermittenfrequenz zu erzielen. Weitere durch die Elektroden-Bauform möglicherweise beeinflusste Aspekte wie Klangqualität oder Höranstrengung sowie der Einfluss individueller kognitiver Fähigkeiten auf das SV mit CI und SV im Störgeräusch waren nicht Gegenstand dieser Studie. Psychoakustische Effekte wurden nicht berücksichtigt.
5 Fazit
Die in der vorliegenden Studie erhobenen Daten konnten die in der Literatur berichtigten Werte für CDL und AID für die hier untersuchten Elektrodenträger weitgehend bestätigen. Es konnte ein signifikanter Zusammenhang zwischen CDL und AID für FLEX28- und PRECURVED-Elektroden festgestellt werden. Zudem konnte bestätigt werden, dass längere Elektrodenträger zu größeren AID und geringerem FV an der apikalsten Elektrode führen. Aufgrund der Variationen der Größe der Cochlea könnte eine präoperative Bestimmung der CDL sinnvoll sein, um einen möglichen Einfluss der anatomiebasierten Auswahl des Elektrodenträgers auf den Zeitraum der Akklimatisation an das CI-vermittelte Hören, die Hörqualität für Sprache und Musik, sowie das Sprachverstehen im Störgeräusch zu untersuchen. Es konnten keine signifikanten Zusammenhänge zwischen FV und EV festgestellt werden, ebenso wenig wie zwischen AID und EV. Weiterhin konnte in der untersuchten Patientenkohorte kein signifikanter Unterschied hinsichtlich des SV in Ruhe zwischen Fällen mit unvollständiger Elektrodeninsertion und deaktivierten Elektroden auf der einen Seite und vollständig inserierten Fällen auf der anderen Seite festgestellt werden. Die Ergebnisse legen nahe, dass der FV möglicherweise nicht so entscheidend für das SV von einsilbigen Prüfwörtern ist, wie bisher angenommen.
5.1 Fazit für die Praxis
- Um eine spezifische Insertionstiefe bezüglich des Einführwinkels der apikalsten Elektrode zu erreichen, wird die Bestimmung der individuellen Länge des Ductus cochlearis empfohlen.
- Die Ergebnisse des Freiburger Einsilbertests in Ruhe nach einem Jahr Cochlea-Implantat Rehabilitation weisen keinen statistisch gesicherten Zusammenhang zum Frequenzversatz des apikalsten Elektrodenkanals auf.
5.2 Ausblick
Die Resultate dieser sowie vorangegangener Studien lassen den Schluss zu, dass Unterschiede im SV patientenspezifische Ursachen haben und nicht maßgeblich auf den FV zurückzuführen sind. In künftigen Forschungsarbeiten sollte der Einfluss des FV auf den Zeitraum bis zum Erreichen eines bestmöglichen Ergebnisses im SV untersucht werden. Es ist hierbei zu prüfen, ob die anatomiebasierte Auswahl des Elektrodenträgers schneller zu guten Hörergebnissen führt. Ein kürzlich erschienener Beitrag der Arbeitsgruppe von Dessard et al. [8] zeigte einen direkten Zusammenhang zwischen der Größe des FV und der Adaptationsgeschwindigkeit der Patienten.
Anmerkungen
Ethikvotum
Für die Durchführung der Studie lag ein positives Votum der Ethikkommission des Fachbereichs Medizin der J. W. Goethe-Universität Frankfurt am Main vor (Geschäftsnummer 2022-642).
Interessenkonflikte
Die Autorin und der Autor erklären, dass sie keine Interessenkonflikte im Zusammenhang mit diesem Artikel haben.
Literatur
[1] Alexiades G, Dhanasingh A, Jolly C. Method to estimate the complete and two-turn cochlear duct length. Otol Neurotol. 2015 Jun;36(5):904-7. DOI: 10.1097/MAO.0000000000000620[2] Breitsprecher T, Mlynski R, Völter C, Van de Heyning P, Van Rompaey V, Dazert S, Weiss NM. Accuracy of Preoperative Cochlear Duct Length Estimation and Angular Insertion Depth Prediction. Otol Neurotol. 2023 Sep;44(8):e566-e571. DOI: 10.1097/MAO.0000000000003956
[3] Breitsprecher TM, Baumgartner WD, Brown K, Dazert S, Doyle U, Dhanasingh A, Großmann W, Hagen R, Van de Heyning P, Mlynski R, Neudert M, Rajan G, Rak K, Van Rompaey V, Schmutzhard J, Volkenstein S, Völter C, Wimmer W, Zernotti M, Weiss NM. Effect of Cochlear Implant Electrode Insertion Depth on Speech Perception Outcomes: A Systematic Review. Otol Neurotol Open. 2023 Dec;3(4):e045. DOI: 10.1097/ONO.0000000000000045
[4] Bruns L, Mürbe D, Hahne A. Understanding music with cochlear implants. Sci Rep. 2016 Aug;6:32026. DOI: 10.1038/srep32026
[5] Canfarotta MW, Dillon MT, Buss E, Pillsbury HC, Brown KD, O'Connell BP. Frequency-to-Place Mismatch: Characterizing Variability and the Influence on Speech Perception Outcomes in Cochlear Implant Recipients. Ear Hear. 2020;41(5):1349-61. DOI: 10.1097/AUD.0000000000000864
[6] Canfarotta MW, O'Connell BP, Giardina CK, Buss E, Brown KD, Dillon MT, Rooth MA, Pillsbury HC, Buchman CA, Adunka OF, Fitzpatrick DC. Relationship Between Electrocochleography, Angular Insertion Depth, and Cochlear Implant Speech Perception Outcomes. Ear Hear. 2021;42(4):941-8. DOI: 10.1097/AUD.0000000000000985
[7] Chakravorti S, Noble JH, Gifford RH, Dawant BM, O'Connell BP, Wang J, Labadie RF. Further Evidence of the Relationship Between Cochlear Implant Electrode Positioning and Hearing Outcomes. Otol Neurotol. 2019 Jun;40(5):617-24. DOI: 10.1097/MAO.0000000000002204
[8] Dessard L, Gersdorff G, Ivanovik N, Zoca-Assadi M, Nopp P, Camby S, Lefebvre PP. Cochlear Implant: Analysis of the Frequency-to-Place Mismatch with the Table-Based Software OTOPLAN® and Its Influence on Hearing Performance. Audiol Neurootol. 2024;29(3):239-45. DOI: 10.1159/000535693
[9] Dhanasingh A, Hochmair I. Signal processing & audio processors. Acta Otolaryngol. 2021 Mar;141(sup1):106-34. DOI: 10.1080/00016489.2021.1888504
[10] Drennan WR, Svirsky MA, Fitzgerald MB, Rubinstein JT. Mimicking normal auditory functions with cochlear implant sound processing; past, present and future. In: Waltzman SB, Roland JT, editors. Cochlear Implants. New York: Thieme; 2014.
[11] Dutrieux N, Quatre R, Péan V, Schmerber S. Correlation Between Cochlear Length, Insertion Angle, and Tonotopic Mismatch for MED-EL FLEX28 Electrode Arrays. Otol Neurotol. 2022 Jan;43(1):48-55. DOI: 10.1097/MAO.0000000000003337
[12] Escudé B, James C, Deguine O, Cochard N, Eter E, Fraysse B. The size of the cochlea and predictions of insertion depth angles for cochlear implant electrodes. Audiol Neurootol. 2006;11 Suppl 1:27-33. DOI: 10.1159/000095611
[13] Greenwood DD. Critical bandwidth and consonance: their operational definitions in relation to cochlear nonlinearity and combination tones. Hear Res. 1991 Aug;54(2):209-46. DOI: 10.1016/0378-5955(91)90118-s
[14] Greenwood DD. Critical bandwidth and the frequency coordinates of the basilar membrane. J Acoust Soc Am. 1961;33:1344-56. DOI: 10.1121/1.1908437
[15] Heutink F, Verbist BM, van der Woude WJ, Meulman TJ, Briaire JJ, Frijns JHM, Vart P, Mylanus EAM, Huinck WJ. Factors Influencing Speech Perception in Adults With a Cochlear Implant. Ear Hear. 2021;42(4):949-60. DOI: 10.1097/AUD.0000000000000988
[16] Ketterer MC, Aschendorff A, Arndt S, Speck I, Rauch AK, Beck R, Hassepass F. Radiological evaluation of a new straight electrode array compared to its precursors. Eur Arch Otorhinolaryngol. 2021 Oct;278(10):3707-14. DOI: 10.1007/s00405-020-06434-5
[17] Koch RW, Ladak HM, Elfarnawany M, Agrawal SK. Measuring Cochlear Duct Length - a historical analysis of methods and results. J Otolaryngol Head Neck Surg. 2017 Mar;46(1):19. DOI: 10.1186/s40463-017-0194-2
[18] Lambriks L, van Hoof M, Debruyne J, Janssen M, Chalupper J, van der Heijden K, Hof J, Hellingman K, Devocht E, George E. Imaging-based frequency mapping for cochlear implants - Evaluated using a daily randomized controlled trial. Front Neurosci. 2023;17:1119933. DOI: 10.3389/fnins.2023.1119933
[19] Landsberger DM, Svrakic M, Roland JT Jr, Svirsky M. The Relationship Between Insertion Angles, Default Frequency Allocations, and Spiral Ganglion Place Pitch in Cochlear Implants. Ear Hear. 2015;36(5):e207-13. DOI: 10.1097/AUD.0000000000000163
[20] Lenarz M, Sönmez H, Joseph G, Büchner A, Lenarz T. Long-term performance of cochlear implants in postlingually deafened adults. Otolaryngol Head Neck Surg. 2012 Jul;147(1):112-8. DOI: 10.1177/0194599812438041
[21] Li H, Helpard L, Ekeroot J, Rohani SA, Zhu N, Rask-Andersen H. Three-dimensional tonotopic mapping of the human cochlea based on synchrotron radiation phase-contrast imaging. Sci Rep. 2021;11:4437. DOI: 10.1038/s41598-021-83225-w
[22] MacPhail ME, Connell NT, Totten DJ, Gray MT, Pisoni D, Yates CW, Nelson RF. Speech Recognition Outcomes in Adults With Slim Straight and Slim Modiolar Cochlear Implant Electrode Arrays. Otolaryngol Head Neck Surg. 2022 May;166(5):943-50. DOI: 10.1177/01945998211036339
[23] McCormack A, Fortnum H. Why do people fitted with hearing aids not wear them? Int J Audiol. 2013 May;52(5):360-8. DOI: 10.3109/14992027.2013.769066
[24] McJunkin JL, Durakovic N, Herzog J, Buchman CA. Early Outcomes With a Slim, Modiolar Cochlear Implant Electrode Array. Otol Neurotol. 2018 Jan;39(1):e28-e33. DOI: 10.1097/MAO.0000000000001652
[25] Mertens G, Van de Heyning P, Vanderveken O, Topsakal V, Van Rompaey V. The smaller the frequency-to-place mismatch the better the hearing outcomes in cochlear implant recipients? Eur Arch Otorhinolaryngol. 2022 Apr;279(4):1875-83. DOI: 10.1007/s00405-021-06899-y
[26] Neumayer HL, Adel Y, Baumann U. Radiologische Bestimmung der Position von Cochlea-Implantat-Elektroden und deren Frequenz-Zuordnung nach unterschiedlichen Modellen [Radiological determination of the position of cochlear implant electrodes and their frequency assignment according to different models]. GMS Z Audiol Audiol Acoust. 2020;2:Doc02. DOI: 10.3205/zaud000006
[27] Peters JPM, Bennink E, van Zanten GA. Comparison of Place-versus-Pitch Mismatch between a Perimodiolar and Lateral Wall Cochlear Implant Electrode Array in Patients with Single-Sided Deafness and a Cochlear Implant. Audiol Neurootol. 2019;24(1):38-48. DOI: 10.1159/000499154
[28] Pietsch M, Schurzig D, Salcher R, Warnecke A, Erfurt P, Lenarz T, Kral A. Variations in microanatomy of the human modiolus require individualized cochlear implantation. Sci Rep. 2022 Mar;12(1):5047. DOI: 10.1038/s41598-022-08731-x
[29] Schindela E. Die Cochlea-Implantatversorgung Erwachsener der HNO-Abteilung im Klinikum Großhadern - Retrospektive Auswertung der Ergebnisse [PhD thesis]. Munich: Ludwig-Maximilians-Universität; 2006. DOI: 10.5282/edoc.5706
[30] Schroeder A. Bilaterale Cochlea Implantat-Versorgung-Einflussfaktoren und deren Auswirkung auf das postoperative Hörergebnis: eine retrospektive Studie [PhD thesis]. Frankfurt am Main: Johann Wolfgang Goethe-Universität; 2016.
[31] Stakhovskaya O, Sridhar D, Bonham BH, Leake PA. Frequency map for the human cochlear spiral ganglion: implications for cochlear implants. J Assoc Res Otolaryngol. 2007 Jun;8(2):220-33. DOI: 10.1007/s10162-007-0076-9
[32] Venail F, Mathiolon C, Menjot de Champfleur S, Piron JP, Sicard M, Villemus F, Vessigaud MA, Sterkers-Artieres F, Mondain M, Uziel A. Effects of electrode array length on frequency-place mismatch and speech perception with cochlear implants. Audiol Neurootol. 2015;20(2):102-11. DOI: 10.1159/000369333
[33] Videhult Pierre P, Eklöf M, Smeds H, Asp F. Cochlear Implantation with the CI512 and CI532 Precurved Electrode Arrays: One-Year Speech Recognition and Intraoperative Thresholds of Electrically Evoked Compound Action Potentials. Audiol Neurootol. 2019;24(6):299-308. DOI: 10.1159/000504592
[34] Zwolan TA, Basura G. Determining Cochlear Implant Candidacy in Adults: Limitations, Expansions, and Opportunities for Improvement. Semin Hear. 2021 Nov;42(4):331-41. DOI: 10.1055/s-0041-1739283
Anhänge
| Anhang 1 | Appendix 1 und 2 (zaud000069_Anhang1.pdf, application/pdf, 200.68 KBytes) |




