Die Relevanz zeitlicher Kodierung für das Richtungshören mit Cochlea-Implantaten
Nicole Rosskothen-Kuhl 1,2Jan W. H. Schnupp 3,4
1 Neurobiologisches Forschungslabor, Sektion für Experimentell-klinische Otologie, Klinik für HNO-Heilkunde, Universitätsklinikum Freiburg, Fakultät für Medizin, Freiburg, Deutschland
2 Bernstein Center Freiburg & Fakultät für Biologie, Universität Freiburg, Deutschland
3 Gerald Choa Neurowissenschaftliches Institut, Chinesische Universität Hongkong, Sha Tin, China
4 Department of Otorhinolaryngology, Head and Neck Surgery, Chinesische Universität Hongkong, Sha Tin, China
Zusammenfassung
Cochlea-Implantate (CIs) haben die Wiederherstellung des Gehörs revolutioniert, wenngleich sie immer noch Limitierungen aufweisen. Während sich viele Forschungsanstrengungen auf die Optimierung der Übertragung von spektralen Informationen konzentrierten, wurde der Nachbildung der präzisen zeitlichen Feuermuster des Hörnervs, die beim normalen Hören beobachtet werden, relativ wenig Aufmerksamkeit geschenkt. Unsere Forschung untersucht Faktoren, die zu dem in der Regel schlechten räumlichen Hören mit CIs beitragen, indem wir die Empfindlichkeit gegenüber interauraler Laufzeitdifferenzen (ITD) bei CI-versorgten Ratten untersuchen. Dieses Tiermodell ermöglicht es uns, Störungen zu umgehen, die sich aus den Bedürfnissen der Patienten und der klinischen Praxis ergeben, und die die Forschung an menschlichen Probanden beeinträchtigen. Wir trainierten und testeten neonatal ertaubte Ratten mit beidseitigen CIs, die durchgängig informative Puls-Timing ITD lieferten. Wir stellten fest, dass ihre ITD-Sensitivitätsschwellen selbst bei klinischen Stimulationsraten genauso gut waren wie die von normalhörenden Ratten. Darüber hinaus konnten wir feststellen, dass die Abgabe von ITD über die Pulsfolge wesentlich effektiver ist als die Präsentation von ITD über die Hüllkurven der Pulsfolge. Zudem können selbst kleine widersprüchliche ITD erhebliche interaurale Pegelunterschiede (ILD) vereiteln. Unsere Ergebnisse deuten stark darauf hin, dass viel bessere binaurale Ergebnisse mit bilateralen CIs erzielt werden könnten, wenn die Patienten durchgängig nützliche und präzise Puls-Timing-Information erhalten würden. Zudem liefern unsere Resultate wichtige Hinweise, warum das uninformative Puls-Timing, das von der Mehrzahl der aktuellen klinischen CI-Prozessoren geliefert wird, das Richtungshören von CI-Patienten behindern kann.
Schlüsselwörter
Taubheit, Prothetik, Cochlea-Implantat, binaurales Hören, interaurale Laufzeitdifferenz, Psychoakustik, Hörerfahrung
Einleitung
Eine grundlegende Funktion des Hörsinns ist die Verarbeitung von zeitlicher Information und unser Gehör scheint zeitliche Beziehungen von Ereignissen weitaus besser und schneller messen und verarbeiten zu können als jeder andere unserer Sinne. Schallwellen sind winzige, aber extrem schnelle Schwankungen des Luftdrucks. Obwohl Schall nur sehr wenig mechanische Energie überträgt, kann unser Gehör erstaunlich präzise die zeitlichen Muster dieser winzigen Druckschwankungen entschlüsseln und uns so wertvolle Informationen über unsere Umwelt liefern.
Das Innenohr leistet einen wesentlichen Beitrag zu dieser zeitlichen Musteranalyse, indem es eine Zeit-Frequenz-Analyse durchgeführt, während die eintreffenden Schallwellen durch die mechanische Filterbank der Cochlea geleitet werden. Dadurch wird einerseits ein Ortscode für den spektralen Inhalt des Schalls im Hörnerv (AN) erstellt, andererseits erzeugt dies aber auch einen Zeitcode, zumal sich Aktionspotentiale der Hörnervenfasern mit Mikrosekunden-Genauigkeit mit den zeitlichen Mustern in jedem Frequenzband synchronisieren. Die Cochlea-Implantat(CI)-Forschung versuchte primär die Übermittlung der ortscodierten Informationen an den AN zu optimieren, indem man beispielsweise versuchte, Wechselwirkungen zwischen benachbarten Elektrodenkanälen durch Maßnahmen wie verschachtelte Abtastung [1] oder Stromfokussierung [2], [3] zu reduzieren. Relativ wenig Anstrengungen wurden jedoch unternommen, um die zeitlich hochpräzisen Feuermuster nachzubilden, die beobachtet werden können, wenn der normal entwickelte Hörnerv natürliche Geräusche kodiert [4]. Die Mehrheit der aktuellen klinischen CI-Prozessoren bieten pulsatile elektrische Stimulation mit einer festen Pulsrate zwischen 900 und 3.700 Pulsen pro Sekunde (pps) auf den meisten oder allen Stimulationskanälen, unabhängig von der zeitlichen Feinstruktur der zu kodierenden Schallwellen [5], [6], [7], [8]. Die Frage, mit der wir uns hier befassen, ist, ob oder inwieweit diese Vernachlässigung der zeitlichen Feinstrukturkodierung in heutigen Stimulationsstrategien eine verpasste Gelegenheit für die optimale Hörwahrnehmung von CI-Patienten darstellt.
In unserer jüngsten Arbeit haben wir versucht, diese Frage in einer Reihe von verhaltensbiologischen und elektrophysiologischen Experimenten zu klären, in denen wir die Fähigkeit von Ratten untersuchten, winzige interaurale Laufzeitdifferenzen (englisch „interaural time differences“ oder kurz ITD) zu erkennen. Das normalhörende auditorische System ist in der Lage, ITD von ein paar zehn Mikrosekunden aufzulösen, und nutzt diese als leistungsfähigen Hinweis für die Lateralisierung von Schallquellen [9], [10] und die Analyse von Hörszenen [11]. Darüber hinaus wurde vermutet, dass die ITD-Unterscheidung und die Fähigkeit des auditorischen Systems, zeitliche Hinweise für die wohl noch wichtigere Tonhöhenwahrnehmung zu nutzen, auf gemeinsamen zugrunde liegenden zeitlichen Verarbeitungsmechanismen im auditorischen Hirnstamm beruhen könnten [12]. Die Unterscheidung von ITD ist daher nicht nur eine bemerkenswerte und hilfreiche Fähigkeit, sondern sie kann auch ein nützlicher Indikator für die allgemeine Kompetenz eines auditorischen Systems sein, zeitliche Hinweise im Sub-Millisekundenbereich zu verarbeiten. Zugleich ist die ITD Unterscheidung sowohl bei menschlichen als auch bei tierischen Probanden relativ leicht experimentell messbar.
ITD-Sensitivität in humanen bilateralen CI-Patienten
Gegenwärtig ist die Empfindlichkeit für ITD bei bilateralen CI-Patienten im Allgemeinen wesentlich schlechter als bei normalhörenden Menschen. Mit Ausnahme der Feinstrukturstrategien FSP/FS4/FS4p der Firma MED-EL, auf die wir am Ende dieses Artikels noch näher eingehen, besteht die klinische Standardpraxis darin, die Patienten mit zwei unabhängigen Prozessoren zu versorgen, die elektrische Pulse mit festen Pulsraten und zu Zeiten abgeben, die von eingehenden Geräuschen oder dem Timing der Pulse im anderen Ohr unabhängig sind. Interessanterweise bleibt die ITD-Empfindlichkeit der CI-Patienten jedoch auch dann schlecht, wenn sie mit experimentellen Prozessoren getestet werden, welche präzise Pulszeiten liefern. Patienten mit einem früh eingetretenen Hörverlust zeigen dabei die schlechteste ITD-Sensitivität. Dies wird beispielsweise von Litovsky et al. [13] gezeigt, welche die Daten einer Kohorte von 34 bilateralen CI-Patienten mit unterschiedlichem Beginn der Taubheit untersuchten. Wir haben ihre Daten hier in Abbildung 1 [Abb. 1] visualisiert. Alle Symbole in Abbildung 1 [Abb. 1] zeigen verhaltensbezogene ITD-Sensitivitätsschwellen, die mit elektrischen Pulsfolgen-Stimuli gemessen wurden, die an Elektroden in der mittleren Windung der Cochlea jedes Ohrs abgegeben wurden. Dabei wurden experimentelle Prozessoren verwendet, welche die Abgabe von ITD mit präzisem Puls-Timing ermöglichen. Die Kreise zeigen die ITD-Schwellen von CI-Patienten, die ihr Gehör entweder im Erwachsenenalter (grüne Kreise), in der Kindheit (blaue Kreise) oder prälingual (rote Kreise) verloren haben. Zum Vergleich zeigt die gestrichelte violette Linie die ungefähre ITD-Schwelle, die man bei normalhörenden Menschen erwarten würde [9], [14], [15], [16].
Abbildung 1: Vergleich der ITD-Verhaltensschwellen für interaurale Laufzeitdifferenzen (ITD) von 34 menschlichen CI-Patienten (Kreise) unterschiedlicher Hörerfahrung versus 16 neonatal ertaubte CI-Ratten (Rauten). Die bilateralen CI-Patienten haben ihr Gehör entweder im Erwachsenenalter (grüne Kreise), in der Kindheit (blaue Kreise) oder prälingual (rote Kreise) verloren. Die Testung erfolgte unter Verwendung von Forschungsprozessoren, welche die Präsentation informativer Puls-ITD ermöglicht. Die schwarzen Rauten zeigen die Schwellenwerte von 16 neonatal ertaubten bilateralen CI-Ratten. Die Tiere erhielten von Stimulationsbeginn ausschließlich informative ITD-Information auf dem Puls-Timing und der Hüllkurve. Menschliche Daten aus [13]. Daten von Ratten aus [25]. Abbildung modifiziert nach [48].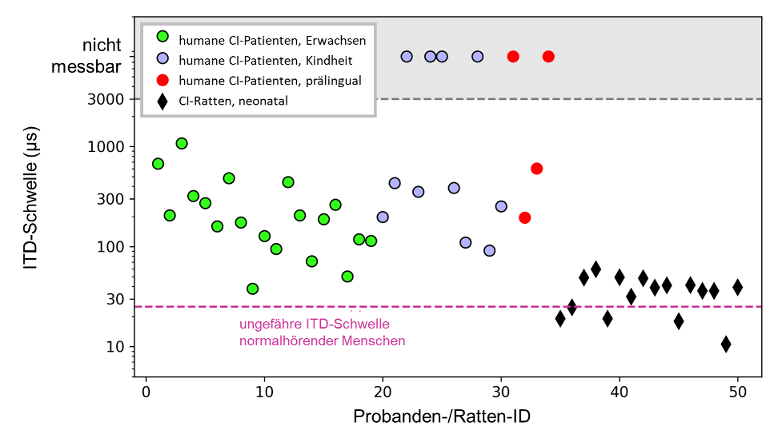
Es wird deutlich, dass nur wenige der CI-Patienten die Leistung von Normalhörenden annähernd erreichen können. Dabei ist zu beachten, dass die Daten gegen eine logarithmische y-Achse aufgetragen sind, um die breite Verteilung der oftmals schlechten Schwellenwerte vieler bilateraler CI-Patienten visualisieren zu können, und nicht, weil das räumliche Hören in irgendeiner Weise logarithmisch mit der ITD skaliert. Die Schwere der Beeinträchtigung der ITD-Empfindlichkeit ist daher größer, als sie visuell erscheinen mag. Für Orte von Schallquellen nahe der Mittellinie skaliert die ITD ungefähr linear mit dem Quellwinkel. Die in Abbildung 1 [Abb. 1] gezeigten erwachsenen, bilateralen CI-Patienten haben eine mittlere ITD-Schwelle von ca. 270 µs. Dies bedeutet, dass die räumliche Auflösung dieses binauralen Hinweises im Durchschnitt etwa zehnmal schlechter ist als bei normalhörenden Probanden. Anhand von Abbildung 1 [Abb. 1] lässt sich auch erkennen, dass CI-Patienten, welche entweder als Kind (blaue Kreise) oder als Säugling (rote Kreise) ertaubten, ein erhöhtes Risiko für eine noch schlechtere oder gar fehlende ITD-Sensitivität besitzen. In der Studie von Litovsky et al. [13] hatten 4 von 11 im Kindesalter ertaubte Patienten, sowie 2 von 4 prälingual ertaubte Patienten, keine nachweisbare ITD-Sensitivität. Eine spätere Studie von Ehlers et al. [17] bestätigte, dass prälingual ertaubte CI-Patienten eine besonders schlechte ITD-Sensitivität aufweisen, und berichtete, dass bei 7 von 10 Patienten die ITD-Schwellen >7.000 µs waren, und damit nicht messbar. Im Gegensatz dazu wies kein einziger der 17 erwachsenen bilateralen CI-Patienten (Abbildung 1 [Abb. 1], grüne Kreise) ITD-Schwellen >7.000 µs auf, wenngleich ihre ITD-Schwellen durchschnittlich zehnmal schlechter waren, als bei normalhörenden Probanden zu erwarten.
Die Beobachtung, dass früh ertaubte CI-Patienten oft eine schlechtere ITD-Sensitivität aufweisen, hat zu der auf den ersten Blick durchaus sinnvollen Schlussfolgerung geführt, dass frühe Taubheit in einem Versagen der binauralen Timing-Schaltkreise des auditorischen Hirnstamms resultiert. Unter Bezug auf die „Hypothese der kritischen Periode“ wurde ein Mangel an auditorischen Eingängen während der frühen Entwicklung des auditorischen Systems dafür verantwortlich gemacht [13], [17], [18]. Die in Abbildung 1 [Abb. 1] reproduzierten Humandaten deuten zwar stark darauf hin, dass erfahrungsabhängige Plastizität eine Rolle bei der Entwicklung des Richtungshörens spielen könnte, sie kann jedoch nicht der einzige Faktor für die schlechtere ITD-Sensitivität von CI-Patienten sein. Ein Argument wäre, dass auch die Kohorte erwachsener CI-Patienten durchschnittlich stark erhöhte ITD-Schwellen aufweist [13], [19], [20], [21], [22], [23].
Leider sind unsere Möglichkeiten, mit freiwilligen, menschlichen CI-Patienten alle im klinischen Kontext relevanten Faktoren zu erforschen, sehr limitiert. Beispielsweise präsentieren die meisten oder gar alle CI-Elektrodenkanäle klinischer CI-Prozessoren ausschließlich unter experimentellen Bedingungen akkurate und damit informative Puls-ITD. In der normalen Nutzung im Alltag sind die Puls-ITD der neuroprothetischen Signale jedoch leider im Wesentlichen Zufallszahlen, und diese sind nicht nur uninformativ, sondern potentiell höchst irreführend. Das Problem liegt dabei darin, dass ein von der Evolution vorprogrammiertes auditorisches System erwartet, nützliche ITD-Information zu erhalten und diese mit anderen Hinweisen zu kombinieren, um das räumliche Hören zu optimieren. Es ist daher anzunehmen, dass die Hörbahn auf eine anhaltende „Diät“ mit unangemessenem Puls-Timing mit einer Desensibilisierung gegenüber einem normalerweise hilfreichen zeitlichen Richtungshinweis reagiert. Darüber hinaus könnte diese Desensibilisierung bei früh ertaubten CI-Patienten, die wenig oder gar keine Erfahrung mit informativen ITD hatten, besonders ausgeprägt sein. Es ist jedoch an humanen Patienten sehr schwierig zu untersuchen, ob dies tatsächlich der Fall ist, zumal bei diesen ein eindeutiger klinischer Bedarf besteht, die derzeit zugelassenen Verarbeitungsstrategien trotz des vermeintlich suboptimalen Puls-Timings weiter zu verwenden, um beispielsweise von den wertvollen Spracherkennungshinweisen zu profitieren. Um diese Vorteile nutzen zu können, müssen die Patienten in der Regel viele Monate lang trainieren, um zu lernen, das Beste aus den bereitgestellten spezifischen und recht unnatürlichen auditorischen Eingängen ihrer CIs zu machen. Dabei ist es wahrscheinlich genau so wichtig, zu lernen, uninformative Muster zu ignorieren, wie informative Muster zu erkennen und auszuwerten. Die Erforschung dieser Möglichkeit ist jedoch mit schwerwiegenden technischen und ethischen Beschränkungen behaftet, da verhindert werden muss, dass die Patienten auf ihrem Weg zu einer optimalen Nutzung der derzeit verfügbaren Standardversorgung behindert werden. Es ist daher nur schwer zu vermeiden, dass die Daten humaner Patienten durch die Auswirkungen der derzeitigen klinischen Praxis beeinträchtigt werden.
ITD-Sensitivität verbessern: Was uns das CI-Tiermodell lehrt
Um die Limitierungen humaner Studien zu überwinden, haben wir ein verhaltensbiologisches Tiermodell entwickelt, das es uns ermöglicht, die ITD-Empfindlichkeit für das Puls-Timing bei CI-Stimulation zu untersuchen, während wir die akustische oder elektrische Hörerfahrung unserer Tiere vollständig kontrollieren. Nachdem wir zeigen konnten, dass normalhörende Ratten ITD-Lateralisierungsaufgaben einfach und schnell lernen können und in der Lage sind, minimale ITD von ~50 µs zu unterscheiden [24], trainierten wir neonatal ertaubte (ND) Ratten, die im jungen Erwachsenenalter bilateral mit CIs (biCI) versorgt wurden, auf ITD-Lateralisation [25], [26]. Die Ergebnisse waren bemerkenswert. Die in Abbildung 1 [Abb. 1] gezeigten schwarzen Rauten demonstrieren die verhaltensbezogenen ITD-Schwellen von 16 ND biCI Ratten, die mit einer Pulsrate von 300 pps getestet wurden [25]. Die mittlere ITD-Schwelle beträgt nur 35 µs und ist nicht signifikant verschieden von denen normalhörender Ratten (Vorzeichen-Rang-Test gegenüber vergleichbaren Daten von [24], p=0,16), während die mittlere ITD-Schwelle der erwachsenen biCI-Patienten ca. zehmal schlechter ist als bei normalhörenden Menschen (Abbildung 1 [Abb. 1]). Kein einziges unserer biCI-Tiere hatte eine erhöhte ITD-Schwelle, obwohl sie während ihrer gesamten Entwicklung bis zur Geschlechtsreife keine auditorischen Eingänge erhielten.
Unsere tierexperimentellen Daten sind sowohl überraschend als auch sehr ermutigend, da sie zeigen, dass trotz früher Taubheit eine im Wesentlichen normale Fähigkeit zur ITD-Lateralisierung durch biCIs zumindest prinzipiell möglich ist. Dies mag vor allem im Lichte früherer elektrophysiologischer Studien an kongenital ertaubten Katzen und neonatal ertaubter Kanninchen überraschend erscheinen [27], [28], [29], [30], [31], [32], [33], da diese über eine vergleichsweise schlechte ITD-Sensitivität im auditorischen Mittelhirn oder Kortex dieser früh ertaubten Tiere berichteten. Ein sorgfältiger Blick auf diese Studien zeigt jedoch, dass die Autoren die ITD in sehr großen Schritten abtasteten und nur sehr wenige ITD-Werte innerhalb des physiologischen Bereichs der Tiere testeten, was die Nützlichkeit dieser Datensätze für die Vorhersage der wahrscheinlichen Fähigkeit eines Tieres zur Unterscheidung von zehn Mikrosekunden kleiner ITD einschränkt. Daher haben wir ITD-Tuningkurven von Neuronen des inferioren Colliculus (IC) in ND biCi-Ratten bestimmt, wobei wir uns auf den physiologischen Bereich der Ratten konzentrierten und ITD in 20 µs-Schritten testeten. Diese elektrophysiologischen Messungen wurden unter Narkose und innerhalb weniger Stunden nach der Implantation durchgeführt, so dass es im Wesentlichen keine Möglichkeit gab, dass erfahrungsabhängige Plastizität die beobachteten neuronalen Tuningkurven hätte beeinflussen können. Die beobachteten neuronalen Antworten sind daher ein Indikator für den „naiven“, fest verdrahteten Zustand eines auditorischen Mittelhirns, das ohne akustische oder prothetische auditorische Stimulation aufgewachsen ist. Selbst in diesem „naiven“, unerfahrenen Zustand zeigten 85% der aufgezeichneten Multiunits (Gruppen von Neuronen) zumindest eine gewisse Sensitivität für ITD im Bereich von ±160 µs, und viele Multiunits modulierten ihre Feuerraten erheblich als Reaktion auf ITD-Änderungen von nur wenigen zehn Mikrosekunden, wie das in Abbildung 2 [Abb. 2] gezeigte Beispiel. Diese Abbildung zeigt eine Multiunit, deren Feuerrate sich halbiert, wenn sich die ITD von 20 µs auf 60 µs (kontralaterale Ohr führt) ändert. Diese Daten zeigen, dass das auditorische Mittelhirn von ND-Tieren in der Lage ist, eine große Menge an Informationen über Puls-Timing-ITD mit einer Auflösung von einigen zehn Mikrosekunden zu kodieren. Dies erklärt auch, warum es nicht schwierig ist, ND CI-Tiere auf die Lateralisation kleiner Puls-ITD zu trainieren.
Abbildung 2: Antworten einer Gruppe von Neuronen (Multiunit) im IC auf binaurale elektrische Pulse mit unterschiedlichen ITD. Die Daten wurden an einer neonatal ertaubten Ratte gemessen, die im jungen Erwachsenenalter mit biCIs implantiert wurde. Negative ITD entsprechen Reizen, bei denen das Ohr kontralateral zur Messposition führend ist. Links: Rasterdiagramm, jeder blaue Punkt zeigt ein Aktionspotenzial, jede Punktreihe zeigt die Reaktionen während eines einzelnen Versuchs, grüne und weiße Bänder gruppieren die Reaktionen auf verschiedene ITD wie links dargestellt. Rechts: Neuronale Tuningkurve für die gleichen Stimuli wie links. Die Fehlerbalken zeigen den SEM-Wert der Antwortamplitude bei 30-facher Darbietung jedes ITD-Stimulus. Basiert auf Abb. 2 von [49].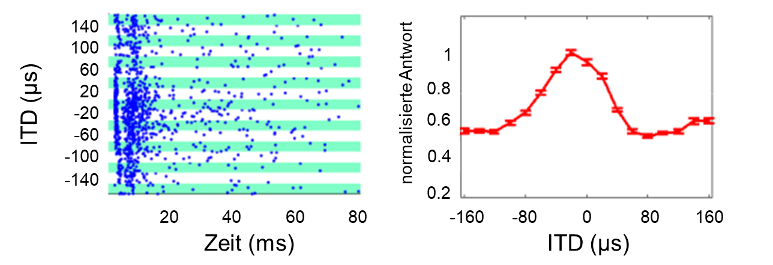
Unsere Beobachtung, dass biCI-Ratten keine Schwierigkeiten bei der Unterscheidung sehr kleiner ITD haben, hat uns neue experimentelle Wege zur Untersuchung von Faktoren für die Entwicklung einer ITD-Sensitivität eröffnet. Wir haben bereits mögliche Einflüsse einer „kritischen Periode“ in der Entwicklung erwähnt. Diese scheint nun weniger wichtig zu sein, da die in Abbildung 1 [Abb. 1] und Abbildung 2 [Abb. 2] gezeigte, hervorragende ITD-Sensitivität von unserer biCI-Ratten ohne frühe Hörerfahrung während ihrer Entwicklung stammen. Natürlich entwickeln sich Menschen viel langsamer als Ratten, und früh ertaubte humane Patienten können in absoluten Zahlen viel längere Zeiträume der auditorischen Deprivation durchlaufen als unsere früh ertaubten Ratten. Wir können daher nicht ausschließen, dass bei humanen Patienten die Auswirkungen der kritischen Periode eine Rolle spielen könnten. Dennoch lassen unsere tierexperimentellen Daten die schlechte ITD-Sensitivität humaner Patienten viel weniger unvermeidlich erscheinen, unabhängig davon, ob ihr Hörverlust sehr früh oder spät im Leben auftrat.
Um andere Faktoren zu ergründen, die zu der verringerten ITD-Sensitivität bei humanen CI-Patienten beitragen könnten, haben wir unser biCI-Rattenmodell verwendet, um zwei wichtige Fragen zu untersuchen: 1) Müssen ITD wirklich durch Puls-Timing vermittelt werden, um Sensitivität im Sub-Millisekundenbereich zu vermitteln, oder könnten ITD auf der Einhüllenden genauso effektiv sein? 2) Wie interagiert die ITD-Empfindlichkeit mit anderen räumlichen Hinweisen wie z.B. interauralen Pegeldifferenzen (ILDs) im CI-stimulierten auditorischen System?
Studien an humanen Patienten, die die relative Wirksamkeit von Puls-ITD im Vergleich zu Hüllkurven-ITD untersuchen, wurden bereits durchgeführt [19], [34], [35], [36]. In Anbetracht der oben beschriebenen Einschränkungen menschlicher Studien konnten zumeist nur Patienten untersucht werden, die nach den Maßstäben von CI-Patienten eine relativ gute ITD-Sensitivität aufwiesen, deren Hörsystem an klinische Prozessoren angepasst war, und es wurden nur Stimuli mit großen ITD-Werten von mehreren hundert Mikrosekunden bei Pulsraten von 50 bis 400 pps verwendet, die für die klinische Praxis in der Regel als zu niedrig eingeschätzt werden. Mit unserem ND biCI-Rattenmodell konnten wir hingegen die relative Wirksamkeit von Puls- und Hüllkurven-ITD in einer Hörbahn untersuchen, die nicht durch monatelangen klinischen Prozessoreinsatz konditioniert wurde, sondern ausschließlich Stimulation mit binauraler Empfindlichkeit fördernder ITD (±80 µs) bei hohen Pulsraten (900 und 4.500 pps) erhielt. Durch solche Verhaltensversuche zeigten wir, dass ND biCI-Ratten unabhängig von den getesteten Hüllkurvenformen und Pulsraten um ein Vielfaches empfindlicher für Puls-ITD als für Hüllkurven-ITD waren [37].
Eine naheliegende Frage ist, wie das Puls-Timing die ITD-Unterscheidung selbst bei so hohen Pulsraten begünstigen kann, zumal man eigentlich erwarten würde, dass bei über 4.000 pps einzelne Pulse gar nicht mehr aufgelöst werden können. Eine mögliche Antwort auf diese Frage ist, dass der auditorische Hirnstamm bei hohen Pulsraten eine Onset-Antwort erzeugt, wenn der erste Puls in der Reizfolge ausreichend groß ist, um eine neuronale Antwort im Hörnerv hervorzurufen. Die von [38] veröffentlichten tierexperimentellen Ergebnisse stützen diese Idee. In diesem Fall sind die Onset-Antworten, die der Hirnstamm für zeitliche Hüllkurvenmerkmale verwendet, immer noch an das zeitliche Raster der Pulse gebunden, die von den Pulstaktgeneratoren jedes CI-Prozessors erstellt werden. Das Puls-Timing bestimmt dann die zeitliche Verarbeitung selbst bei so hohen Pulsraten, bei denen der auditorische Hirnstamm nicht mehr in der Lage ist, jeden Einzelpuls darzustellen. Unsere experimentellen Daten zeigen jedenfalls deutlich, dass das Timing der Pulse eine große Rolle spielt und nicht durch präzise Hüllkurven-ITD ersetzt werden kann. Die Entscheidung von CI-Firmen, das Puls-Timing in den meisten oder allen Elektrodenkanälen von den zeitlichen Eigenschaften des eintreffenden Schalls völlig unabhängig zu machen, ist daher sehr wahrscheinlich folgenreich für die CI-Patienten. Jüngste Simulationsstudien der Gruppe von Josh H. McDermott stützen unsere Schlussfolgerung. Indem sie mögliche Ursachen für die schlechtere Hörleistung von CI-Patienten in Modellen des CI-vermittelten Hörens simulieren, liefern sie wichtige Hinweise darauf, dass die übliche klinische Bereitstellung zeitlicher Informationen ausschließlich über die Hüllkurve der elektrischen Stimulation unzureichend ist [39].
Ein bilateraler CI-Patient mit klinischen Prozessoren erhält derzeit im wesentlichen zufällige Puls-ITD, die durch die relative Phasenverzögerung zwischen den beiden Pulsgeneratoren erzeugt werden und unabhängig voneinander das linke bzw. das rechte Ohr stimulieren. Unter der Annahme, dass die Prozessoren des CI-Patienten mit Pulsraten von ca. 1.000 pps arbeiten, empfangen die jeweiligen Kanäle in jedem Ohr unabhängig voneinander etwa einen Puls pro Millisekunde, und die Puls-ITD sind folglich Zufallszahlen zwischen Null (Pulse sind zufällig synchron) und 500 µs (Puls fällt in einem Ohr genau in die Mitte zwischen zwei Pulsen im anderen Ohr). Die Phasenbeziehung zwischen den beiden Prozessoren verschiebt sich darüber hinaus auf unvorhersehbare und von den eingehenden Geräuschen unabhängige Weise. Die Frage ist, was wir von einem frisch implantierten, noch unerfahrenen auditorischen System erwarten würden, das solche uninformative, zufällige Puls-ITD verarbeiten soll. Beim normalen Raumhören werden ITD-Hinweise unbewusst mit ILD und anderen Hinweisen kombiniert, um eine integrierte Wahrnehmung des Quellenorts zu bilden. Wenn ITD- und ILD-Hinweise voneinander abweichen, versucht das Gehör normalerweise, einen Kompromiss für die Ortsbestimmung zu finden. So kann zum Beispiel ein Geräusch, das im linken Ohr etwas lauter, im rechten Ohr aber etwas früher zu hören ist, als auf der Mittellinie liegend wahrgenommen werden. Dies ist ein Phänomen, das als Time-Intensity-Trading bezeichnet wird. Die relative Stärke von ITD- und ILD-Hinweisen bei der Gestaltung der räumlichen Gesamtwahrnehmung wird als Time-Intensity-Trading-Ratio (TITR) bezeichnet und in µs/dB quantifiziert [40], [41], [42], [43]. Um die mögliche Auswirkung von ITD mit zufälligem Puls-Timing klinischer Prozessoren zu verstehen, wäre es wichtig, die TITR für das CI-stimulierte auditorische System in seinem ursprünglichen Zustand zu kennen. Je stärker die TITR dabei zugunsten der ITD gewichtet wird (d.h. je kleiner die TITR sind), desto größer ist das Potenzial, dass zufällige Puls-ITD die nützliche ILD-Information überstimmen, und das Raumhöhen von CI-Patienten damit irreführen können.
Vor kurzem haben wir Experimente zur Untersuchung der Wechselwirkungen zwischen ITD- und ILD-Hinweisen in ND biCI-Ratten abgeschlossen. Abbildung 3 [Abb. 3] zeigt eine Teilmenge der Daten [44]. Das linke Feld von Abbildung 3 [Abb. 3] zeigt einen Auszug aus der Pulsfolge zweier Stimuli, die für die Verhaltensexperimente verwendet wurden. Die biCI-Ratten wurden darauf trainiert und getestet, Stimuli zu lateralisieren, bei denen die ILD und die Puls-ITD unabhängig voneinander variiert wurden. Positive ILD- und ITD-Werte bevorzugen hier das rechte Ohr und negative Werte das linke Ohr. Der Übersicht halber betrachten wir hier nur zwei besonders aufschlussreiche Stimuli aus einem größeren Satz von Teststimuli: einen Stimulus mit –4 dB ILD (linkes Ohr lauter) und 0 ITD (Abbildung 3 [Abb. 3] links oben) und einen Stimulus mit –4 dB ILD (linkes Ohr lauter) und +80 µs Puls-ITD (rechtes Ohr zeitlich führenden) I (Abbildung 3 [Abb. 3] links unten). Das rechte Feld zeigt den Prozentsatz der Fälle, in denen die vier ND biCI-Ratten diese Reize auf die rechte Seite lateralisierten. Angesichts der deutlichen ILD, die die linke Seite bevorzugt, lateralisierten alle vier Tiere den –4 dB/0 µs-Reiz erwartungsgemäß in der überwiegenden Mehrheit (ca. 70%) der Versuche nach links. Bei allen vier Tieren sehen wir jedoch auch eine statistisch signifikante Wahrnehmungsverschiebung nach rechts, wenn die –4 dB ILD mit einer +80 µs ITD gepaart war. Drei von 4 Tieren hörten den Stimulus nun mehrheitlich rechts. Somit reichte eine relativ kleine und widersprechende ITD von nur +80 µs aus, um einen relativ starken ILD-Hinweis von –4 dB auszulöschen. In einer früh ertaubten und damit hörunerfahrenen Hörbahn ohne längere Konditionierung mit klinischen Prozessoren scheint die TITR folglich in der Größenordnung von 20 µs/dB oder weniger zu liegen.
Abbildung 3: Verhaltensdaten von vier neonatal ertaubten, bilateral CI-versorgten Ratten, die auf die Lateralisierung binauraler CI-Pulsfolgen mit unterschiedlichen ITD oder ILD trainiert wurden. Links: Auszug aus einer beispielhaften binauralen Pulsfolge: Die Pulse für das linke Ohr haben eine um 4 dB größere Amplitude als die Pulse für das rechte Ohr und werden entweder synchron (0 µs ITD, oben) oder etwas früher im rechten Ohr (+80 µs ITD, unten) präsentiert. Rechts: Prozentsatz der Versuche, bei denen die Ratten den Stimulus rechts lateralisierten als Funktion der auf der x-Achse dargestellten Stimulusparameter.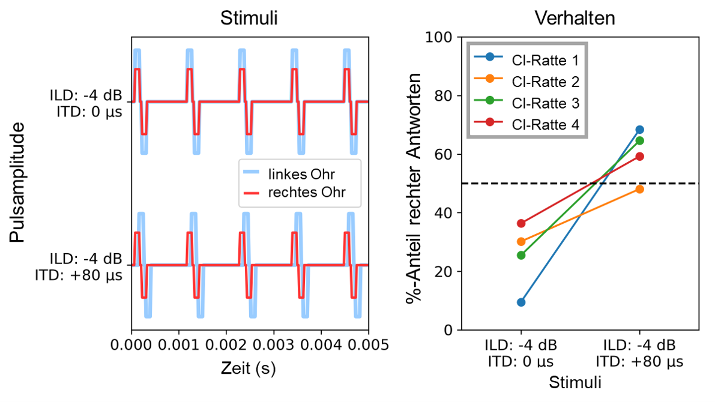
Wenn wir davon ausgehen, dass die Mechanismen zur Extraktion und Kombination binauraler Signale bei allen Säugetierarten im Wesentlichen ähnlich sind, was würde dann eine TITR in der Größenordnung von 20 µs/dB für einen prälingual tauben Patienten bedeuten, der gerade mit klinischen Prozessoren versorgt wurde? In Anbetracht der oben beschriebenen Beobachtungen würden wir nicht nur erwarten, dass das auditorische System dieses Patienten anfänglich selbst für kleine Puls-ITD sehr empfindlich ist, sondern wir würden außerdem erwarten, dass diese ITD-Sensitivität sehr stark gewichtet wird, wenn ITD- und ILD-Hinweise kombiniert werden. Durch einfache Extrapolation einer TITR von ~20 µs/dB würde man vorhersagen, dass zufällige Puls-ITD von beispielsweise 500 µs in der Lage sein könnten, informative ILD von bis zu 25 dB zu stören. Um diese Zahl in das richtige Verhältnis zu rücken, müssen wir berücksichtigen, dass beim elektrischen CI-Hören der gesamte dynamische Bereich der kodierbaren Reizintensitäten mit etwa 10 bis 20 dB erheblich reduziert ist gegenüber akustischem Hören [45]. In diesem Szenario könnten also die zufällig erzeugten Puls-ITD klinischer Geräte selbst die größten ILD durcheinanderbringen, die mit biCIs überhaupt angeboten werden können. Zugegebenermaßen ist die hier vorgenommene lineare Extrapolation über einen so großen Bereich von binauralen Hinweisen möglicherweise nicht ganz gültig, aber die Daten in Abbildung 3 [Abb. 3] zeigen dennoch deutlich, dass eine „falsche“ Puls-ITD selbst von geringer Größe das Potenzial hat, eine „richtige“ ILD zu maskieren. Gegenwärtig scheint es naheliegend anzunehmen, dass diese Situation auch auf menschliche biCI-Patienten zutrifft, deren auditorisches System ständig mit uninformativen Puls-ITD von ihren klinischen Prozessoren bombardiert wird. Wir gehen daher davon aus, dass diese Patienten irgendwie „lernen“ müssen, unempfindlich für irreführende Puls-ITD zu werden, um auf der Basis der bereitgestellten, informativen ILD überhaupt binaural hören zu können. Die schlechtere ITD-Sensitivität von CI-Trägern ist daher wahrscheinlich das Ergebnis eines Anpassungsprozesses, bei dem die normalerweise ausgezeichnete zeitliche Empfindlichkeit des binauralen Systems unterdrückt wird, weil die von ihm gesammelten Informationen unter klinischer Stimulation nur stört. Die in Abbildung 1 [Abb. 1] beschriebene, schlechtere ITD-Sensitivität früh ertaubter Patienten könnte darauf zurückzuführen sein, dass diese Patienten besonders wenig Erfahrung mit nützlichem ITD-Input hatten, und relativ früh mit Implantaten versorgt wurden, wenn die Hörbahn noch plastischer war, und gelernt hat, den nicht hilfreichen ITD-Input zu unterdrücken. Dieser Prozess scheint insofern maladaptiv, da es die ITD-Sensitivität des auditorischen Systems reduziert, die eigentlich gut entwickelt sein sollte, jedoch in diesem Kontext das System nur verwirrt. Die Hypothese, dass eine längere Exposition gegenüber uninformativen Puls-ITD zu einer Abnahme der ITD-Sensitivität führen sollte, lässt sich im Prinzip experimentell in unserem Verhaltensmodell für Ratten testen, und entsprechende Experimente werden derzeit in unseren Laboren durchgeführt.
Der Vollständigkeit halber wollen wir abschließend eine Ausnahme klinischer Prozessoren der Firma MED-EL vorstellen, die bereits seit 2010 ihren CI-Patienten über die Feinstrukturstrategien FS4 bzw. FS4-p auf 4 der insgesamt 12 Stimulationskanäle Puls-Timing ITD bereitstellt durch Detektion und Synchronisation auf die Nulldurchgänge des akustischen Signals [46]. Dies sollte grundsätzlich die Möglichkeit bieten, wenigstens in den tieffrequenteren Kanälen eine bessere ITD-Wahrnehmung zu entwickeln, da das auditorische System dieser Patienten dort mit informativen Puls-ITDs versorgt wird. Eine Studie von Fischer et al. [47] deutet darauf hin, dass der Vorteil der FS4-Feinstrukturkodierung kontextabhängig sein könnte. Wurden FS4 CI-Patienten mit niederfrequenten Tönen getestet, so zeigten sie eine verbesserte ITD-Diskrimination im Vergleich zur Nutzung einer Startegie ohne Feinstrukturkodierung (HDCIS). Dieser Benefit ging allerdings verloren, sobald die Patienten mit Breitbandgeräuschen im Freifeld getetstet wurden. Eine mögliche Erklärung dafür wäre, dass bei breitbandigen Signalen die Mehrheit der CI-Frequenzkanäle (8 der insgesamt 12 Stimulationselektroden) irreführende Puls-ITD liefert, so dass der Benefit der Feinstrukturkodierung auf den Kanälen 1 bis 4 überdeckt wird. Im natürlichen Hören von breitbandigen Signalen sind ITD-Werte über alle Frequenzkanäle koordiniert. Zusammenfassend halten wir es für wichtig, biCI-Patienten soviel wie möglich an natürlichen Hinweisen über die elektrische Stimulation bereitzustellen, und beispielweise die Präsentation von Feinstrukturinformation in klinische Prozessoren zu integrieren. Unserer Meinung nach stellen Feinstrukturkodierungsstrategien einen wichtigen Schritt in die richtige Richtung dar. Zukünftig könnte die Bereitstellung von informativen Puls-ITD über die gesamte Cochlea in einer darüber hinausgehenden Verbesserung des Richtungshörens von biCI-Patienten resultieren.
Schlussfolgerung
Unsere Daten zeigen, dass Tiermodelle bei der Suche nach möglichen Ursachen für das eingeschränkte Hörvermögen von CI-Patienten von einzigartigem Nutzen sind. Anhand von früh ertaubten CI-Ratten haben wir gezeigt, dass die ITD-Sensitivität für CI-Reize im Prinzip genauso gut sein kann wie bei Normalhörenden, selbst nach einer erheblichen Periode auditorischer Deprivation während der frühen Entwicklung. Zudem zeigten wir, dass eine gute ITD-Empfindlichkeit selbst bei relativ hohen klinischen Pulsraten (~900 pps) erreicht werden kann. In Experimenten, in denen wir Richtungshinweise auf den Pulsen und der Hüllkurve gegeneinander austauschten, oder in denen wir Puls-ITD gegen ILD setzen, konnten wir bestätigen, dass Mikrosekunden akkurates Puls-Timing eine wesentliche Rolle spielt. Sie können nicht durch zeitliche Hüllkurvenmerkmale ersetzt werden und die angeborene Empfindlichkeit gegenüber Pulszeit-ITD wäre stark genug, um die korrekte Lateralisierung von ILD-Hinweisen mit CIs zu stören, wenn das auditorische System einer zufälligen Pulszeit ausgesetzt ist. Die in Abbildung 3 [Abb. 3] gezeigten Daten deuten also darauf hin, dass die normalerweise recht gute Fähigkeit von bilateralen CI-Patienten, ILD-Hinweise zu nutzen, davon abhängen könnte, dass sie ihre Empfindlichkeit für ITD verlieren. Die Entscheidung von CI-Firmen, das Puls-Timing völlig unabhängig von den zeitlichen Eigenschaften der ankommenden Töne in den meisten oder allen Elektrodenkanälen zu machen, ist daher wahrscheinlich eine Hauptursache für das schlechte Richtungshören von bilateralen CI-Patienten.
Anmerkungen
Danksagung
Wir bedanken uns bei Sarah Buchholz, Alexa N. Buck, Hendrike Budig, Cecilia Li und Theresa Preyer für die Unterstützung bei den tierexperimentellen Studien und der Datenanalyse. Die Arbeiten dieser Veröffentlichung wurden unterstützt vom Deutschen Akademischen Austauschdienst (DAAD) mit Mitteln des Bundesministeriums für Bildung und Forschung (BMBF) und dem Programm „Menschen“ (Marie-Curie-Maßnahmen) des Siebten Rahmenprogramms (FP7/2007-2013) der Europäischen Union, Fördervereinbarung Nr. 605728 (Postdoctoral Researchers International Mobility Experience) sowie durch Zuschüsse des Hong Kong General Research Fund (11103524 & 11100219), des Hong Kong Health and Medical Research Fund (07181406 & 06172296), dem Shenzhen Science Technology and Innovation Committee (JCYJ20180307124024360), dem Martin Lee Centre for Innovations in Hearing Health an der Macquarie University, der Forschungskommission der Medizinischen Fakultät des Universitätsklinikums Freiburg und der Wohltätigkeitsorganisation „Taube Kinder lernen hören e.V.“. Tierelektroden wurden freundlicherweise von MED-EL Medical Electronics, Innsbruck, Österreich (Forschungsvereinbarung PVFR2019/2), zur Verfügung gestellt.
Ethik
Alle hier beschriebenen Verfahren an Versuchstieren wurden gemäß der Genehmigung des Regierungspräsidiums Freiburg (Nr. 35-9185.81/G-17/124) und des Gesundheitsministeriums von Hongkong (Nr. 16-52 DH/HA&P/8/2/5) durchgeführt. Sie wurden außerdem vom Animal Research Ethics Sub-Committee der City University of Hong Kong genehmigt.
Interessenkonflikte
Die Autorin und der Autor erklären, dass sie keine Interessenkonflikte im Zusammenhang mit diesem Artikel haben.
Literatur
[1] Wilson BS, Finley CC, Lawson DT, Wolford RD, Eddington DK, Rabinowitz WM. Better speech recognition with cochlear implants. Nature. 1991 Jul 18;352(6332):236-8. DOI: 10.1038/352236a0[2] Zhu Z, Tang Q, Zeng FG, Guan T, Ye D. Cochlear-implant spatial selectivity with monopolar, bipolar and tripolar stimulation. Hear Res. 2012 Jan;283(1-2):45-58. DOI: 10.1016/j.heares.2011.11.005
[3] Quass GL, Kral A. Tripolar configuration and pulse shape in cochlear implants reduce channel interactions in the temporal domain. Hear Res. 2024 Mar 1;443:108953. DOI: 10.1016/j.heares.2024.108953
[4] Cariani PA, Delgutte B. Neural correlates of the pitch of complex tones. I. Pitch and pitch salience. J Neurophysiol. 1996 Sep;76(3):1698-716. DOI: 10.1152/jn.1996.76.3.1698
[5] Middlebrooks JC. Cochlear-implant high pulse rate and narrow electrode configuration impair transmission of temporal information to the auditory cortex. J Neurophysiol. 2008 Jul;100(1):92-107. DOI: 10.1152/jn.01114.2007
[6] Saddler MR, McDermott JH. Models optimized for real-world tasks reveal the task-dependent necessity of precise temporal coding in hearing. Nat Commun. 2024 Dec 4;15(1):10590. DOI: 10.1038/s41467-024-54700-5
[7] Borjigin A, Bharadwaj HM. Individual differences elucidate the perceptual benefits associated with robust temporal fine-structure processing. Proc Natl Acad Sci U S A. 2025 Jan 7;122(1):e2317152121. DOI: 10.1073/pnas.2317152121
[8] Wohlbauer DM, Dillier N. A Hundred Ways to Encode Sound Signals for Cochlear Implants. Annu Rev Biomed Eng. 2025 May;27(1):335-69. DOI: 10.1146/annurev-bioeng-102623-121249
[9] Klumpp R, Eady H. Some measurements of interaural time difference thresholds. J Acoust Soc Am. 1956;28:859-60.
[10] Brown CH, May BJ. Comparative mammalian sound localization. In: Popper AN, Fay RR, editors. Sound Source Localization. New York: Springer; 2005. p. 124-78.
[11] Klump GM. How Does the Hearing System Perform Auditory Scene Analysis? In: van Hemmen JL, Sejnowski TJ, editors. 23 Problems in Systems Neuroscience. Oxford: Oxford University Press; 2006. p. 303-21.
[12] Ihlefeld A, Shinn-Cunningham B. Disentangling the effects of spatial cues on selection and formation of auditory objects. J Acoust Soc Am. 2008 Oct;124(4):2224-35. DOI: 10.1121/1.2973185
[13] Litovsky RY, Goupell MJ, Godar S, Grieco-Calub T, Jones GL, Garadat SN, Agrawal S, Kan A, Todd A, Hess C, Misurelli S. Studies on bilateral cochlear implants at the University of Wisconsin's Binaural Hearing and Speech Laboratory. J Am Acad Audiol. 2012 Jun;23(6):476-94.
[14] Zwislocki J, Feldman RS. Just Noticeable Dichotic Phase Difference. J Acoust Soc Am. 1956;28:152-3. DOI: 10.1121/1.1918072
[15] Brughera A, Dunai L, Hartmann WM. Human interaural time difference thresholds for sine tones: the high-frequency limit. J Acoust Soc Am. 2013 May;133(5):2839-55. DOI: 10.1121/1.4795778
[16] Thavam S, Dietz M. Smallest perceivable interaural time differences. J Acoust Soc Am. 2019 Jan;145(1):458. DOI: 10.1121/1.5087566
[17] Ehlers E, Goupell MJ, Zheng Y, Godar SP, Litovsky RY. Binaural sensitivity in children who use bilateral cochlear implants. J Acoust Soc Am. 2017 Jun;141(6):4264. DOI: 10.1121/1.4983824
[18] Kral A. Auditory critical periods: a review from system's perspective. Neuroscience. 2013 Sep 5;247:117-33. DOI: 10.1016/j.neuroscience.2013.05.021
[19] Majdak P, Laback B, Baumgartner WD. Effects of interaural time differences in fine structure and envelope on lateral discrimination in electric hearing. J Acoust Soc Am. 2006 Oct;120(4):2190-201. DOI: 10.1121/1.2258390
[20] Laback B, Majdak P, Baumgartner WD. Lateralization discrimination of interaural time delays in four-pulse sequences in electric and acoustic hearing. J Acoust Soc Am. 2007 Apr;121(4):2182-91. DOI: 10.1121/1.2642280
[21] Laback B, Egger K, Majdak P. Perception and coding of interaural time differences with bilateral cochlear implants. Hear Res. 2015 Apr;322:138-50. DOI: 10.1016/j.heares.2014.10.004
[22] Thakkar T, Anderson SR, Kan A, Litovsky RY. Evaluating the Impact of Age, Acoustic Exposure, and Electrical Stimulation on Binaural Sensitivity in Adult Bilateral Cochlear Implant Patients. Brain Sci. 2020 Jun 26;10(6):406. DOI: 10.3390/brainsci10060406
[23] Cleary M, Bernstein JGW, Stakhovskaya OA, Noble J, Kolberg E, Jensen KK, Hoa M, Kim HJ, Goupell MJ. The Relationship Between Interaural Insertion-Depth Differences, Scalar Location, and Interaural Time-Difference Processing in Adult Bilateral Cochlear-Implant Listeners. Trends Hear. 2022 Jan-Dec;26:23312165221129165. DOI: 10.1177/23312165221129165
[24] Li K, Chan CHK, Rajendran VG, Meng Q, Rosskothen-Kuhl N, Schnupp JWH. Microsecond sensitivity to envelope interaural time differences in rats. J Acoust Soc Am. 2019 May;145(5):EL341. DOI: 10.1121/1.5099164
[25] Buck AN, Buchholz S, Schnupp JW, Rosskothen-Kuhl N. Interaural time difference sensitivity under binaural cochlear implant stimulation persists at high pulse rates up to 900 pps. Sci Rep. 2023 Mar 7;13(1):3785. DOI: 10.1038/s41598-023-30569-0
[26] Rosskothen-Kuhl N, Buck AN, Li K, Schnupp JW. Microsecond interaural time difference discrimination restored by cochlear implants after neonatal deafness. Elife. 2021 Jan 11;10:e59300. DOI: 10.7554/eLife.59300
[27] Tillein J, Hubka P, Syed E, Hartmann R, Engel AK, Kral A. Cortical representation of interaural time difference in congenital deafness. Cereb Cortex. 2010 Feb;20(2):492-506. DOI: 10.1093/cercor/bhp222
[28] Tillein J, Hubka P, Kral A. Sensitivity to interaural time differences with binaural implants: is it in the brain? Cochlear Implants Int. 2011 May;12 Suppl 1:S44-50. DOI: 10.1179/146701011x13001035753344
[29] Hancock KE, Chung Y, Delgutte B. Neural ITD coding with bilateral cochlear implants: effect of binaurally coherent jitter. J Neurophysiol. 2012 Aug 1;108(3):714-28. DOI: 10.1152/jn.00269.2012
[30] Hancock KE, Chung Y, Delgutte B. Congenital and prolonged adult-onset deafness cause distinct degradations in neural ITD coding with bilateral cochlear implants. J Assoc Res Otolaryngol. 2013 Jun;14(3):393-411. DOI: 10.1007/s10162-013-0380-5
[31] Chung Y, Hancock KE, Delgutte B. Neural Coding of Interaural Time Differences with Bilateral Cochlear Implants in Unanesthetized Rabbits. J Neurosci. 2016 May 18;36(20):5520-31. DOI: 10.1523/jneurosci.3795-15.2016
[32] Tillein J, Hubka P, Kral A. Monaural Congenital Deafness Affects Aural Dominance and Degrades Binaural Processing. Cereb Cortex. 2016 Apr;26(4):1762-77. DOI: 10.1093/cercor/bhv351
[33] Chung Y, Buechel BD, Sunwoo W, Wagner JD, Delgutte B. Neural ITD Sensitivity and Temporal Coding with Cochlear Implants in an Animal Model of Early-Onset Deafness. J Assoc Res Otolaryngol. 2019 Feb;20(1):37-56. DOI: 10.1007/s10162-018-00708-w
[34] van Hoesel RJ, Tyler RS. Speech perception, localization, and lateralization with bilateral cochlear implants. J Acoust Soc Am. 2003 Mar;113(3):1617-30. DOI: 10.1121/1.1539520
[35] Laback B, Pok SM, Baumgartner WD, Deutsch WA, Schmid K. Sensitivity to interaural level and envelope time differences of two bilateral cochlear implant listeners using clinical sound processors. Ear Hear. 2004 Oct;25(5):488-500. DOI: 10.1097/01.aud.0000145124.85517.e8
[36] Noel VA, Eddington DK. Sensitivity of bilateral cochlear implant users to fine-structure and envelope interaural time differences. J Acoust Soc Am. 2013 Apr;133(4):2314-28. DOI: 10.1121/1.4794372
[37] Schnupp JWH, Buchholz S, Buck AN, Budig H, Khurana L, Rosskothen-Kuhl N. Pulse timing dominates binaural hearing with cochlear implants. Proc Natl Acad Sci U S A. 2025 Apr 22;122(16):e2416697122. DOI: 10.1073/pnas.2416697122
[38] Hancock KE, Chung Y, McKinney MF, Delgutte B. Temporal Envelope Coding by Inferior Colliculus Neurons with Cochlear Implant Stimulation. J Assoc Res Otolaryngol. 2017 Dec;18(6):771-88. DOI: 10.1007/s10162-017-0638-4
[39] Banerjee A, Saddler MR, McDermott JH. Understanding Cochlear Implants Using Machine Learning. In: Proceedings of the 47th MidWinter Meeting of the Association for Research in Otolaryngology, Anaheim, USA. 2024.
[40] George Moushegian LAJ. Role of Interaural Time and Intensity Differences in the Lateralization of Low-Frequency Tones. J Acoust Soc Am. 1959;31(11):1441-5.
[41] Durlach N, Colburn H. Binaural phenomena. In: Carterette E, Friedman ME, editors. Handbook of Perception. 4th ed. New York: Academic Press; 1978. p. 365-465.
[42] Trahiotis C, Kappauf WE. Regression interpretation of differences in time-intensity trading ratios obtained in studies of laterality using the method of adjustment. J Acoust Soc Am. 1978 Oct;64(4):1041-7. DOI: 10.1121/1.382087
[43] Joris PX, Michelet P, Franken TP, McLaughlin M. Variations on a Dexterous theme: peripheral time-intensity trading. Hear Res. 2008 Apr;238(1-2):49-57. DOI: 10.1016/j.heares.2007.11.011
[44] Buchholz S, Schnupp JWH, Arndt S, Roßkothen-Kuhl N. Interaural level difference sensitivity in neonatally deafened rats fitted with bilateral cochlear implants [Preprint]. bioRxiv. 2024. DOI: 10.1101/2024.07.30.605756
[45] Zeng FG, Grant G, Niparko J, Galvin J, Shannon R, Opie J, Segel P. Speech dynamic range and its effect on cochlear implant performance. J Acoust Soc Am. 2002 Jan;111(1 Pt 1):377-86. DOI: 10.1121/1.1423926
[46] Dhanasingh A, Hochmair I. Signal processing & audio processors. Acta Otolaryngol. 2021 Mar;141(sup1):106-34. DOI: 10.1080/00016489.2021.1888504
[47] Fischer T, Schmid C, Kompis M, Mantokoudis G, Caversaccio M, Wimmer W. Effects of temporal fine structure preservation on spatial hearing in bilateral cochlear implant users. J Acoust Soc Am. 2021 Aug;150(2):673. DOI: 10.1121/10.0005732
[48] Carlyon RP, Deeks JM, Delgutte B, Chung Y, Vollmer M, Ohl FW, Kral A, Tillein J, Litovsky RY, Schnupp J, Rosskothen-Kuhl N, Goldsworthy RL. Limitations on Temporal Processing by Cochlear Implant Users: A Compilation of Viewpoints. Trends Hear. 2025 Jan-Dec;29:23312165251317006. DOI: 10.1177/23312165251317006
[49] Buck AN, Rosskothen-Kuhl N, Schnupp JW. Sensitivity to interaural time differences in the inferior colliculus of cochlear implanted rats with or without hearing experience. Hear Res. 2021 Sep 1;408:108305. DOI: 10.1016/j.heares.2021.108305




